RESUMEN
Descripción de varios procedimientos industriales de recuperación del estaño contenido en los recortes de hojalata desechados por la industria metalgrafica. De ellos se deduce que el realmente interesante es el que obtiene este estaño por un proceso en seco por lixiviación con cloro.
INTRODUCCIÓN
El estaño es el componente más específico de la hojalata, que le aporta su principal característica: su resistencia a la corrosión ante la acción de elementos externos. Es un metal de elevado precio en el mercado, ya que su obtención a partir de mineral, además de ser costosa, está muy controlada por grandes empresas multinacionales que procuran mantener el precio alto y escasez de oferta ante una demanda importante. Por ello en ciertos periodos y en algunas zonas geográficas, es frecuentemente interesante plantearse la recuperación de este metal partiendo de recortes desechados de hojalata procedentes de las fábricas de envases. De ahí que consideramos interesante reproducir parcialmente un articulo de Pedro López Gómez publicado bajo el titulo “LA RECUPERACIÓN DEL ESTAÑO DE LA HOJALATA” en la revista “Técnica Industrial”
“El contenido de estaño en la hojalata es variable, entre el 2% en las chapa gruesa al 4.5% en la delgada. Como criterio general no pueden beneficiarse económicamente recortes que no contengan por lo menos un 2% de estaño.
Debe de extremarse el desestañado para que el soporte de acero Matin – alma de la hojalata – pueda ser empleado de nuevo como chatarra. La presencia de estaño, aun en pequeña cantidad ejerce influencia considerable sobre la ductibilidad del acero y basta un contenido del 0.3% de Sn para que se vuelva quebradizo e inadecuado como acero de recuperación.
Como bien sabemos la hojalata está formada por una capa externa de estaño casi puro, fácilmente separable; debajo se observa otra capa cristalina formada por una verdadera aleación estaño-hierro más difícil de separar por estar fuertemente adherida a la chapa soporte y ser dificultosamente atacable.
TRABAJOS PRELIMINARES
Antes de aplicar cualquier método de desestañado es preciso limpiar a fondo los recortes de hojalata y eliminar en todo lo posible grasas, tintas, barnices y residuos orgánicos que puedan llevar.
Para ello se preparan paquetes perforados que se someten a una especie de fusión previa a baja temperatura para eliminar la mayor cantidad posible de estaño. Previamente a esta operación se debe eliminar los barnices que cubre los recortes. Para ello el barniz se disuelve fácilmente en una lejía alcalina de sosa Solvay o cáustica al 10%; si se observan residuos esmaltados, los paquetes de hojalata se pasan por una calandria de rodillos dispuestos de modo que uno de los cilindros trabaje a mayor velocidad que el otro, con lo que el paquete se ondula y salta el esmalte.
Existen equipos en el mercado como el de “Goldschmidt TH”, que prensa y perfora los recortes con unos cilindros de púas, y saponifica las grasas y barnices con un tratamiento con lejía sódica al 3% durante quince-treinta minutos en autoclave a 110-115º C, lava posteriormente con agua caliente para eliminar jabones y restos de lejía y posteriormente calienta durante media hora a unos 500º C para recuperar la capa externa de estaño y consigue destruir así la materia orgánica – gomas de cierre – y vuelve a prensar.
En esta operación ha puesto mucho cuidado en no formar cock de la materia orgánica, que más tarde dificultaría la penetración de los agentes de desestañado.
Los procesos conocidos de desestañado pueden clasificarse en cuatro grandes grupos:
a).- Procesos químicos por vía húmeda.
b).- Procesos metalúrgicos por vía seca
c).- Procesos electrolíticos mediante solución en ácidos o álcalis.
d).- Procesos que emplean cloro seco
Veremos cada uno de ellos a continuación.
PROCESOS QUÍMICOS POR VÍA HÚMEDA
Durante mucho tiempo se ha intentado la recuperación del estaño de la hojalata utilizando procesos químicos de disoluciones de ácidos, álcalis o disoluciones salinas, desistiendo de continuar su empleo por tener rendimientos bajos en toda ocasión.
Kecth y Hette iniciaron este camino con la vista puesta en una electrolisis posterior; pero Goldsch-Midt demostró que al disolver el estaño mediante ácidos se disuelve al mismo tiempo hierro, de difícil y costosa separación. Los álcalis solos o adicionados de agentes oxidantes no atacan al hierro, pero tampoco eliminan completamente al estaño, con lo que el acero de la chapa tampoco puede utilizarse industrialmente.
Schulze trata la hojalata con solución de cloruro estánnico; este disuelve estaño metálico para reducirse a sal estannosa:
Cl4Sn + Sn = 2 Cl2Sn
Y a continuación pasa vapor de agua, con lo que precipita oxicloruro estannoso y regenera el cloruro estánnico, que vuelve al ciclo:
6 Cl2Sn + 2 H2O + O2 = 4 ClSnOH + 2 Cl4Sn
Se filtra el ClSnOH separado y se le transforma en oxido estánnico SnO2 por oxidación al rojo en presencia de aire con desprendimiento de cloro, que se recupera:
4 SnClOH + 3 O2 = 4 SnO2 + C l2 + 2 H2O
También se empleó el cloruro ferrico en vez de cloruro estánnico como disolvente, pues si Cl3Fe está presente en exceso, el estaño se oxida y el hierro se reduce:
4 Cl3Fe + Sn = Cl4Sn + 4 Cl2Fe
Cuando casi todo el cloruro ferrico ha oxidado al estaño formando cloruro estánnico, este se reduce con el estaño en exceso presente y pasa a cloruro estannoso.
Cl4Sn + Sn = 2 Cl2Sn
Que con vapor de agua se transforma en cloruro básico estannoso y por posterior calcinado obtendremos oxido estánnico y recuperaremos el cloro necesario para regenerar el cloruro ferrico por oxidación del Cl2Fe:
2 Cl2Fe + Cl2 = 2 Cl3Fe
Que vuelve al ciclo de lixiviación; en ambos casos el oxido estánnico se reduce a metal en un horno apropiado.
Reinecken-Ponsgenykopp trata los residuos de hojalata en unos tambores rotativos con PbO – oxido pulga – y vapor de agua, con lo que consigue – en presencia de la lejía de sosa previamente añadida – formar estannato sódico SnO3Na2.3H2O y separar plomo metal.
El estannato sódico puede ponerse en el mercado concentrado o cristalizado, o en una operación posterior precipitar el estaño mediante una corriente gaseosa de anhídrido carbónico, y subsiguiente reducción en un horno de reverbero.
PROCESOS METALURGICOS POR VÍA SECA
Este proceso se reduce a una separación del estaño por fusión y oxidación en parte a “cenizas de estaño”, las cuales se reducen en horno de reverbero o disuelven en metales fundidos, o para formar directamente sales o un aprovechamiento del metal por simple fusión y separación mecánica de las gotas de estaño líquido.
Por ejemplo Laroque mezcla los residuos de hojalata con carbón vegetal – que apenas tiene ceniza – y cloruro sodio, y Edmunds funde los recortes de hojalata a temperatura suficiente para que se licue el estaño en una centrifugadora provista en su parte central de un hogar especial, con lo que las gotitas de estaño fundido son separadas mediante fuerza centrifuga.
Wolterez trata los residuos de hojalata en retortas con vapor de agua recalentado a 450-500º C, para separar el estaño del hierro mediante la fusión; en estas condiciones el estaño no se oxida porque está expuesto a la acción reductora del hidrogeno producido por reducción del vapor de agua sobre el hierro recalentado; tan solo puede detectarse, y no frecuentemente, una tenue película de oxido sobre la capa exterior del estaño liquido; también se han ensayado procesos que hacen actuar sodio fundido sobre el recorte de hojalata; tienen la ventaja de disolver completamente el estaño, con lo que queda un recorte de acero en inmejorables condiciones para que con un simple forjado volverlo a emplear, pero el proceso es complicado, molesto y peligroso, como se deduce de la marcha del proceso que a grandes rasgos relatamos: una serie de depósitos estancos y enlazados convenientemente con tuberías, todo ello estaba construido en acero y trabajaba como un exhaustor; en la cabecera se introducen los recortes de hojalata junto con sodio puro o aleación sodio-estaño; una vez cerrado herméticamente el aparato recalentaba a 400-500º C en un horno de gas; se hacia el vacío y se agitaba el contenido, con lo que el estaño se disuelve en unos quince minutos: continuando la lixiviación en ciclo continuo se llega a una aleación 50/50; ahora solo resta recuperar el sodio por destilación para obtener el estaño.
PROCESOS ELECTROLÍTICOS
Al principio se trabajó con electrolito acido: acido sulfúrico, sulfato acido de sodio y cloruros; con este tipo de electrolito los rendimientos resultaban bajos y pronto fue abandonado. Hoy se emplea exclusivamente el electrolito básico, pero vamos a dar una ligera idea de cómo en sus tiempos se trabajaba.
Gutensonn trabajaba con un electrolito de acido sulfúrico al 10% calentado a 60º C. Formaba el ánodo con los paquetes de hojalata colocados en cestas de madera de 1200 x 300 x 800 mm. es decir con un volumen de 0.288 metros cúbicos, en tanto que .los baños de aproximadamente un metro cúbico de capacidad se construían con madera de pino o de haya de 50 mm de espesor, revestidas con 3.5 mm de espesor de caucho comprimido. Los cátodos estaban formados con chapas de cobre estañado de 1200 x 0.50 x 1.5 mm; en cada baño se disponían ocho cajas anódicas y 16 cajas catódicas separadas 100 mm unas de otras. Las características de trabajo eran 240 A, 15 V que teóricamente deberían separa 4.15 kg. de estaño por hora, pero el rendimiento practico apenas llegaba al 45% por gastarse el resto de la corriente en trabajos de disolución del hierro y desprendimiento de hidrogeno, por lo que se obtenía un estaño bastante puro.
En el proceso alcalino el electrolito es NaOH al 10%, lo demás permanece; ahora el estaño pasa a disolución como estannato sodio de formula SnO3Na2, muy soluble que se precipita en forma de metal sobre el cátodo.
La precipitación es más lenta que la disolución, con lo que el electrolito va paulatinamente enriqueciéndose en estaño, aunque con velocidad decreciente.
Un particular enemigo del rendimiento en corriente es la avidez de la lejía sodica del electrolito por el anhídrido carbonico atmosférico; al carbonatarse el NaOH pierde actividad de disolución y conductibilidad eléctrica, lo que impone la servidumbre de renovar el electrolito con demasiada frecuencia para por caustificación eliminar el carbonato sodico formado y las impurezas disueltas en el ánodo; conviene remover con frecuencia el electrolito para que el ánodo solo ceda iones estannosos.
La temperatura de trabajo se centra en las proximidades de los 70º C con una densidad anódica de 18 A/m2 y 100 A/m2 en la región catódica, con lo que si el electrolito contiene un 10% de álcalis libre, el rendimiento en corriente anódica se sitúa en el 94-95%, si repentinamente cesa la electrolisis, desaparecen los iones estannosos y se manifiesta de inmediato una elevación de la tensión en bornes de 0.7-1.2 V aproximadamente.
Ahora con toda probabilidad, comienza el desestañado de la aleación hierro-estaño; la tensión aumenta rápidamente a 1.8 V y solo permanece en la chapa un 0.08% de estaño; es decir aproximadamente el 2.40% de la cantidad total a recuperar; el rendimiento en corriente es ahora del 88-89%, que va disminuyendo hasta el 82-83% conforme el voltaje crece a 2.5 V y solamente queda por recuperar un 0.02 % de Sn, que representa el 0.05-0.06 % de la cantidad contenida primariamente en el recorte
La retracción del rendimiento eléctrico demuestra que el trabajo anódico se centra principalmente sobre el hierro; este se vuelve pasivo y desprende oxigeno, lo que rebaja el rendimiento en corriente.
El color del residuo anódico no es determinante ni indicativo sobre el grado de lixiviación del estaño; si con un contenido de 0.28% de Sn es de color gris azulado y con un 0.02% de Sn rojizo, ya con un 0.08% muestra eflorescencia rojiza.
Por otra parte, si el electrolito está total o parcialmente carbonatado o la agitación es poco vigorosa, el grado de desestañado disminuye poco, pero la tensión en bornas aumenta y el rendimiento en corriente disminuye.
El porcentaje de estaño en el electrolito no debe ser superior al 2.34%; en caso contrario la saturación dificulta el ataque anódico y como secuencia desagradable puede formarse ácido meta estánnico hidratado insoluble – no recuperable – que se pierde en los lodos anódicos.
El proceso alcalino más rápido y económico que el acido exige mucha vigilancia; sobre el método al electrolito acido presenta la ventaja que produce un residuo de acero de mucha aceptación en las acerías, en tanto que el residuo anódico del proceso que trabaja con electrolito acido solo puede usarse para la obtención de sulfato ferroso.
El proceso ácido tiene, por otra parte la ventaja de que el estaño pasa a la solución como ion estannoso, con lo que teóricamente con la misma cantidad de culombios debe separarse doble cantidad de estaño metal.
PROCESO EN SECO POR LIXIVIACIÓN POR CLORO
La palabra lixiviación viene del latín: “Lixivia, -ae” sustantivo femenino que significa lejía. Los romanos usaban este término para referirse a los jugos que destilan las uvas antes de pisarlas, o las aceitunas antes de molerlas. En la actualidad, se denomina lixiviación, al lavado de una sustancia pulverizada para extraer las partes solubles.
Propuesto por Higgins y perfeccionado por Parmelee, Lambotte Goldsmitd y Weber ha barrido industrialmente a los demás métodos de extracción porque el cloro seco disuelve con facilidad al estaño y permite separarlo en forma de cloruro estánnico sin atacar al acero soporte; el Alemania se recupera por este proceso más del 85% de la producción de recortes.
Winteler obtiene cloruro estánnico haciendo obrar cloro seco sobre la hojalata en recortes a una temperatura controlada de 40-50º, puesto que en este intervalo de temperatura el cloro no ataca al hierro; para que esto suceda es necesario que la temperatura en el reactor de lixiviación supere los 100º C; si por un descuido se forma cloruro ferrico, se dirá en términos metalúrgicos que la “lata se ha quemado”; hay que tomar en consideración que la reacción:
2Cl2 + Sn = Cl4Sn
Libera 127,25 Kcal/mol. de cloruro estánnico formado, que puede anular el rendimiento de la lixiviación por la elevación de la temperatura que se produce. El punto crítico se centra en la entrada del cloro en el reactor; por la gran densidad especifica de los moles de cloro presentes, ávidos de reaccionar, puede formarse una ligera capa de cloruro férrico anhidro, cristalino, que por su higroscopicidad absorbe la humedad del recinto y desde este momento la disolución del hierro en forma de tricloruro de hierro puede manifestarse con una velocidad tremenda en toda la chapa; este problema fue resuelto por Weber J. refrigerando intensamente el reactor, con lo que mejoraba el proceso y obtenia agua caliente para el lavado de la lata recuperada.
La técnica de la recuperación del estaño de la hojalata se centra en la propiedad del cloro seco de atacar fácilmente al estaño y respetar el hierro soporte en tanto y en cuanto en el reactor no haya vestigio alguno de humedad; económicamente no puede ser viable si no se dispone de cantidades suficientes de cloro seco barato y con este proceso en una sola operación se obtienen simultáneamente los dos componentes de la hojalata. Por un lado, cloruro estánnico de gran valor por su aplicación en la tintura de fibras textiles – seda, etc -, y por otro, acero o hierro dulce perfectamente desestañado con menos de 0.1% de Sn. Frente a los otros métodos de recuperación, el proceso de desestañado por cloro seco solo presenta ventajas:
– Los proceso primero y segundo presentados, son anticuados, de resultados inciertos, precisan costosas instalaciones y el costo del estaño recuperado no compensa más que en condiciones especiales de un país.
– Cuando se electroliza con el electrolito acido se consume demasiada energía, puesto que un 50-35 % de la cantidad total de faradays suministrados se consume en trabajos de disolución de hierro y generación de hidrogeno; las instalaciones son onerosas, muy expuestas a sufrir continuas y graves averias como todas las que trabajan con líquidos ácidos, con lo que el rendimiento economito no es brillante y el estaño resulta demasiado caro para ser puesto en el mercado.
– La electrolisis de electrolito básico presenta algunas ventajas técnicas sobre las de electrolito ácido; sin embargo, su elevado consumo de energía – 3.000 kWh/Tm – de estaño recuperado no sostiene el tratamiento al precio a que se factura el kWh y por necesitar una instalación demasiado compleja, como están hoy las cosas, seria un sonado milagro que pudiera dar rendimiento económico.
– El desestañado mediante la acción del cloro seco sobre los recortes de hojalata resuelve elegante y sencillamente el problema; necesita poca fuerza instalada, poco personal, poca inmovilización dineraria y el subproducto puede venderse bien a las acerias sin problemas tras un simple lavado.
Cloro líquido se encuentra sin mucha dificultad – lo fabrica Solvay y Cia.- el problema más difícil es establecer una línea de acopio de recorte de hojalata congruente y que funcione bien.
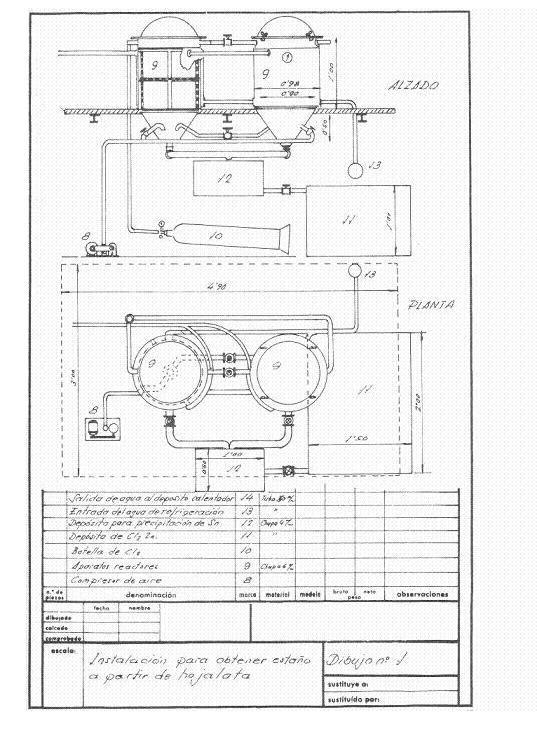
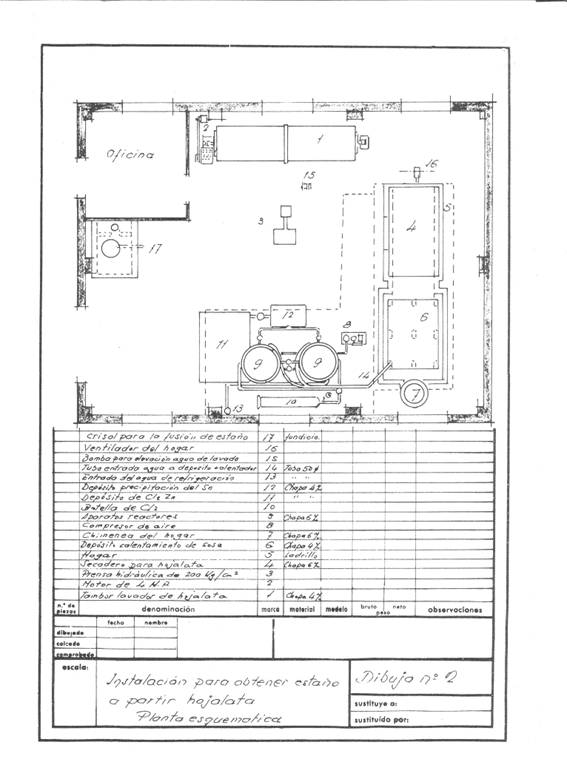
Las figuras 1 y 2 dan idea de la instalación que se proyectó; se pensaba en una frecuencia de recuperación de 4 toneladas diarias de recorte trabajando a un turno y pensada para trabajar en campañas.
Figura nº 1: Ejemplo 1º de instalación de desestañado
Figura nº2: Ejemplo 2º de instalación de desestañado
Al recibir los recorte en la instalación, la primera operación que se hacia era lavarlos con aproximadamente 2 metros cúbicos de una disolución de 11-12 Be de densidad de carbonato sódico; que pesa 2160 kg y contiene 1250 kg de sosa cristalina – pureza 98% -, tratamiento cuya misión es saponificar los desechos de grasas que pueden contener los recortes y eliminar tintas y barnices.
La saponificación es una reacción química entre un ácido graso (o un lípido saponificable, portador de residuos de ácidos grasos) y una base o álcali, en la que se obtiene como principal producto la sal de dicho ácido y de dicha base. Estos compuestos tienen la particularidad de ser anfipáticos, es decir tienen una parte polar y otra apolar (o no polar), con lo cual pueden interactuar con sustancias de propiedades dispares. Por ejemplo, los jabones son sales de ácidos grasos y metales alcalinos que se obtienen mediante este proceso. El método de saponificación en el aspecto industrial consiste en hervir la grasa en grandes calderas, añadiendo lentamente sosa cáustica (NaOH), agitándose continuamente la mezcla hasta que comienza esta a ponerse pastosa.
Esta operación se efectúa en tambor rotatorio de unos 3.14 metros cúbicos de capacidad y usa superficie de lavado de unos 14.13 m2, construida en chapa de hierro de 4 mm de espesor y arrastrada por un motor de 4 CV.
Terminada la operación de lavado se decantaban la solución alcalina junto los jabones en un deposito de unos 3 m3 de capacidad, situado encima del horno de secado de la hojalata para mantenerla caliente y poder volverla a emplear en nuevos tratamientos hasta su agotamiento.
Los recortes exentos de grasa, barnices y tintas se enjuagan con agua caliente que con generosidad se obtiene en la refrigeración de los reactores de desestañado.
Los recortes limpios se prensan en paquetes prismáticos de 400 x 170 x 200 mm, fácilmente manejables, pues pesan unos 50 kg, en una prensa hidráulica a unos 200 kg/cm2.
Estos paquetes se secan a presión atmosferita a unos 200º C durante dos horas, con un consumo promedio de 150 kg de hulla de 7000 Kcal/kg. La cámara de secado era una especie de secadero de estantes – sin mucha entidad – construido de “fortuna”, donde un ventilador mediano inyectaba el aire caliente para arrastrar el agua por la chimenea: Todo iba convenientemente aislado con una capa de magnesia del 85%, de 60 mm de espesor y 280 kg de peso, y antes de enviarlo a la atmosfera se le hacia ceder calorías en exceso para calentar las soluciones del proceso, la chimenea de 500 mm de diámetro apenas sobresalía del tejado.
Los reactores de desestañado eran dos en serie, en ellos y a conveniencia se podía soplar aire seco para pasar los remanentes de cloro del reactor terminado al otro, de modo y manera que mientras uno desestañaba, del otro se extraía el cloruro estánnico y el acero recuperado.
Al empezar la jornada se cargaban los dos reactores con los paquetes de hojalata prensados y secos. En el primero se dejaba cloro seco a 2 atm. de presión y se dejaba manar el agua de refrigeración, el gas cloro se expande en la superficie libre del reactor y actúa sobre el estaño de la hojalata; esta absorbe continuamente cloro, en tanto que hay estaño sin reaccionar, y cuando todo el estaño se ha transformado en cloruro estánnico la presión permanece constante y se da por terminado el ataque. Después de un intervalo de tiempo adecuado se sopla el aparato con aire seco para arrastrar el exceso de cloro al reactor en conserva, que una vez cerrado empieza a trabajar, en tanto que del reactor terminado se extrae por el fondo todo el cloruro estánnico formado mediante soplado, y cuando ya no gotea se saca la masa de acero desestañado, se lava bien con solución de carbonato sódico caliente, luego se enjuaga con el agua caliente del reactor y se obtiene un residuo de acero dulce muy ventajoso para las acerias. Trabajando así hemos recuperado 251 kg de cloruro estánnico y consumido 230-240 kg de cloro.
Esta cifra de cloruro estánnico recuperado representa una recuperación de 115 kg de estaño metálico, es decir, un rendimiento de recuperación del 96%, con lo que el hierro residual contiene solo el 0.10-0.13 % de estaño, lo que permite enviarlo a las acerias sin problemas.
Como la reacción de disolución es muy exotérmica, para lograr un buen rendimiento es necesario vigilar con mucho cuidado la refrigeración,: en caso contrario se corre el cierto peligro de quemar la lata.
El cloro liquido se encuentra en el comercio en botellas de acero similares a las de oxigeno, acetileno, anhídrido carbónico, etc; contienen 50 kg de peso neto a 6 atm y cada kilogramo de cloro liquido suministra 334 litros de gas cloro seco.
Consumíamos durante el tiempo de trabajo 5 botellas al día para lixiviar las 4 Tm de recorte; dejábamos expansionar al cloro líquido de 6 a 2 atm, para lo cual utilizábamos un manoreductor de presión comercial.
Como por entonces escaseaba el estaño metal también pusimos a punto un proceso de reducción para el cloruro estánnico. Para ello pensamos poner en marcha una reducción electrolítica sin gasto de corriente y con una instalación minima; parece un contrasentido, pero tras los pertinentes ensayos, la idea no era descabellada, solo teníamos que desarrollar un aprovechamiento de la diferencia de tensión existente entre cinc y estaño. Estudiando el problema llegamos a una certeza: vimos que una lámina de cinc introducida en una solución de cloruro estánnico ligeramente acidulado con acido clorhídrico (pH=5-6), efectuaba los siguientes trabajos:
Cl4Sn + 2 Zn = 2 Cl2Zn + Sn
Cl4Sn + Sn = 2 Cl2Zn
2 Cl2Sn + 2 Zn = 2 Cl2Zn + 2 Sn
Lo que se traduce en la consideración de que todo el cinc se disuelve y que todo el estaño precipita en forma esponjosa de carácter metálico, que se recoge, lava y refunde para obtener lingote.
Según las reacciones escritas, son precisos 65 kg de cinc para recuperar todo el estaño del cloruro estánnico formado. Empleábamos chapas de cinc de 1 mm de espesor que tienen un peso por metro cuadrado de 6.9 kg y por tanto, necesitabamos unos 9,5 metros cuadrados de chapa de cinc diariamente.
Hicimos para ello una instalación de “fortuna”. Construimos un recipiente de 1000 x 600 x 500 mm y colocamos en él láminas de cinc suspendidas de armazones de madera. Una vez terminada la precipitación tomábamos la esponja de estaño con unas paletas de madera, las retirábamos y las lavábamos bien con agua caliente y se fundían en un crisol de hierro fácilmente a unos 231.5º C con un consumo de hulla de 6-7 % de una granza de 7000 Kcal/kg.
Una vez en fusión tranquila se removía el líquido mediante unas ramas de madera verde para desoxidar; se retiraba la escoria y el líquido depurado se introducía en lingoteras, con lo que se lograba un metal con una pureza del 99,3 al 99,7 % apto para soldar y fabricar bronces y otras aleaciones.
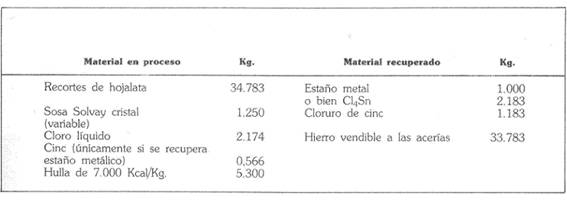
La tabla que a continuación damos es un somero balance del material de la operación, establecido para una producción de una tonelada de metal, equivalente a 2.183 kg de cloruro estánnico.”















Excelente artículo, me fue bastante útil para un proyecto que estoy realizando. El artículo de Pedro Lopez Gomez, lo puedo encontrar en PDF?. Sucede que necesito leer ese archivo para completar mi documentación. Les agradezco.