SUMMARY
冶金産業で廃棄されるブリキの端材に含まれるスズを回収するための様々な工業プロセスの説明。 その中から、本当に興味深いのは、この錫を塩素で浸出する乾式法で得ているものだと推察できる。
イントロダクション
ブリキの最も特異な成分であるスズは、ブリキの最大の特徴である外的要因による腐食への耐性をもたらします。 これは、鉱石から得るのが高価なだけでなく、多国籍の大企業によって高度に管理されているため、市場での価格が高い金属であり、大きな需要があるにもかかわらず、価格を高く保ち、供給を不足させようとするものです。 そのため、ある時期、ある地域では、包装工場から廃棄されたブリキの端材からこの金属を回収することがしばしば検討されます。 そこで、「Técnica Industrial」誌に「LA RECUPERACIÓN DEL ESTAÑO DE LA HOJALATA」というタイトルで掲載されたPedro López Gómez氏の記事を一部ご紹介したいと思います。
「ブリキの錫含有量は、厚板で2%、薄板で4.5%とばらつきがあります。 一般的な基準として、スズが2%以上含まれていない挿し木は、経済的な利益を得ることができません。
ブリキの芯となるマチン鋼の支持体は、スクラップとして再利用できるように、脱錫しなければならない。 スズの存在は、たとえ少量であっても鋼の延性にかなりの影響を与え、Snが0.3%含まれているだけで脆くなり、回復用の鋼としては不向きになります。
ご存知のように、ブリキは外層がほぼ純粋なスズで構成されており、これは簡単に分離できます。その下には、本物のスズと鉄の合金で形成された別の結晶層がありますが、これは支持シートに強く付着していて攻撃されにくいため、分離するのはより困難です。
準備作業
どのような脱錫方法を採用するにしても、その前にブリキの端材を徹底的に洗浄し、グリース、インク、ワニス、有機物の残留物を可能な限り取り除かなければなりません。
そのために、穴のあいたパッケージを用意し、低温で予備溶解してスズをできる限り除去します。 この作業の前に、挿し穂を覆っているワニスを取り除く必要があります。 この目的のために、ワニスは10%のアルカリ性ソルベイまたは苛性ソーダの灰汁で簡単に溶かすことができる。エナメルの残留物が見える場合は、ブリキのパケットを、一方のシリンダーが他方のシリンダーよりも高い速度で働くように配置されたローラーカレンダーに通し、パケットをカールさせてエナメルを飛ばしてしまう。
Goldschmidt TH」のような装置が市販されており、スパイク付きのシリンダーで端材をプレスして穿孔し、110〜115℃のオートクレーブで15〜30分間、3%のナトリウム灰汁処理で油脂やワニスを鹸化した後、温水で洗浄して石鹸や灰汁の残留物を除去し、続いて500℃で30分加熱して錫の外層を回収し、シーリングガムという有機物を破壊して再びプレスする。
その際、脱塩剤の浸透を妨げる有機物のコックを作らないように細心の注意を払っている。
既知の脱膜プロセスは、大きく4つに分類されます。
a) – 湿式化学プロセス
(b) – 乾式冶金プロセス
(c)・・・酸やアルカリに溶かして電気分解すること。
(d) – 乾燥塩素を使用するプロセス
以下、それぞれを見ていきましょう。
湿式化学プロセス
ブリキからのスズの回収は、酸やアルカリ、塩水などの化学プロセスを用いて長い間試みられてきましたが、一貫して低い収率のために断念されてきました。
KecthとHetteは、その後の電気分解を視野に入れてこの道を歩み始めたが、Goldsch-Midtは、錫を酸で溶かすと、分離が困難でコストのかかる鉄も同時に溶けることを示した。 アルカリだけ、あるいは酸化剤を加えても、鉄を侵すことはないが、錫も完全には除去できないので、工業的には使えない。
シュルツはブリキを塩化第一鉄溶液で処理する。塩化第一鉄溶液は、ブリキ金属を溶かして塩化第一鉄塩にする。
Cl4Sn + Sn = 2 Cl2Sn
その後、水蒸気が通過してオキシ塩化第一鉄が析出し、塩化第一鉄が再生されて再び循環する。
6 Cl2Sn + 2 H2O + O2 = 4 ClSnOH + 2 Cl4Sn
分離されたClSnOHはろ過され、空気の存在下で塩素を放出しながら赤色酸化することで、スタニックオキサイドSnO2に変化し、回収される。
4 SnClOH + 3 O2 = 4 SnO2 + C l2 + 2 H2O
また、Cl3Feが過剰に存在すると、スズが酸化され、鉄が還元されるため、溶媒として塩化第一スズの代わりに塩化第二鉄が使用された。
4 Cl3Fe + Sn = Cl4Sn + 4 Cl2Fe
塩化第二鉄のほとんどすべてがスズを酸化して塩化第二スズになると、余ったスズと一緒に還元されて塩化第二スズになります。
Cl4Sn + Sn = 2 Cl2Sn
これを蒸気で塩基性塩化第一鉄に変え、その後の焼成で酸化第一鉄を得て、Cl2Feの酸化で塩化第二鉄を再生するのに必要な塩素を回収する。
2 Cl2Fe + Cl2 = 2 Cl3Fe
浸出サイクルに戻りますが、どちらの場合もスタンニック・オキサイドは適切な炉で金属に還元されます。
Reinecken-Ponsgenykopp社では、ブリキの廃棄物を回転ドラムの中でPbO(オキサイド・フリー)と水蒸気で処理し、あらかじめ加えておいたソーダの灰汁の存在下で、錫酸ナトリウムSnO3Na2.3H2Oを形成し、鉛の金属を分離することに成功している。
濃縮または結晶化した形で市場に出すこともできるし、その後の作業で、二酸化炭素のガス流を使ってスズを沈殿させ、その後、反射炉で還元することもできる。
乾式製錬プロセス
このプロセスは、溶融と酸化によってスズを分離し、部分的に「スズ灰」にして反射炉で還元したり、溶融金属に溶かしたり、直接塩を形成したり、あるいは単純な溶融と液体スズ液滴の機械的分離によって金属を利用したりする。
例えば、Laroque氏はブリキの廃棄物に灰分の少ない木炭と塩化ナトリウムを混ぜ、Edmunds氏はブリキの端材を液化するのに十分な温度で、中央に特殊な炉を備えた遠心分離機で溶かし、溶けたブリキの液滴を遠心力で分離している。
ウォルターズは、ブリキの廃棄物を450〜500℃に加熱した蒸気の入ったレトルトで処理し、溶解によってブリキを鉄から分離します。このような条件下では、加熱された鉄の上で蒸気が還元されることによって生じる水素の還元作用にさらされるため、ブリキは酸化しません。ブリキの切断面に溶融ナトリウムを作用させる方法も試みられている。この方法は、ブリキを完全に溶解し、単純な鍛造で再利用できる優れた状態の鋼の切断面を残すことができるという利点があるが、ここで大まかに説明しているプロセスの進行状況から推測できるように、プロセスは複雑で、面倒で、危険である。上部にはブリキの切りくずと純粋なナトリウムまたはナトリウム-スズ合金を入れ、密閉した後、ガス炉で400~500℃に加熱し、真空にして内容物を撹拌すると、約15分でブリキが溶解したという。浸出を連続的に繰り返すと50対50の合金になり、あとは蒸留でナトリウムを回収してスズを得るだけです。
電解プロセス
当初は、硫酸、硫酸ナトリウム、塩化物などの酸性電解質を用いていたが、この種の電解質では収率が低く、すぐに放棄された。 現在では基本的な電解質しか使われていませんが、過去にどのように使われていたかを少し紹介します。
グーテンソンは、60℃に加熱した10%硫酸の電解液で動作した。彼は、1200×300×800mmの木製バスケットに入れたブリキの束で陽極を形成し、その体積は0.288立方メートルで、約1立方メートルの容量を持つ浴槽は、厚さ50mmの松やブナの木で作られ、厚さ3.5mmの圧縮ゴムで裏打ちされていた。陰極は1200×0.50×1.5mmの錫メッキされた銅板で、各槽には100mm間隔で陽極ボックスが8個、陰極ボックスが16個設置されていた。作業特性は240A、15Vで、理論的には1時間に4.15kgのスズを分離できるが、残りの電流は鉄を溶かして水素を放出するのに使われ、かなり純度の高いスズが得られるため、実際の収率は45%にとどまった。
アルカリプロセスでは、電解液は10%のNaOHで、残りの部分は残っています。ここでスズは、非常に溶けやすい式SnO3Na2のスズ酸ナトリウムとして溶液になり、陰極に金属として析出します。
析出は溶解よりも遅いため、電解液中のスズは減少しながらも徐々に濃縮されていきます。
特に電流効率の悪さは、電解液中の灰汁酸ナトリウムが大気中の二酸化炭素に強いことである。NaOHが炭酸化すると溶解活性と導電性が失われるため、生成した炭酸ナトリウムと苛性化によって陽極に溶解した不純物を除去するために、電解液を頻繁に更新する必要があるのだ。
作業温度は70℃近辺、陽極密度は18A/m2、陰極領域は100A/m2で、電解液に遊離アルカリが10%含まれている場合、陽極電流効率は94~95%となる。 電解が突然停止すると、スタナスイオンが消失し、直ちに端子電圧が約0.7~1.2V上昇する。
電圧が1.8Vまで急速に上昇し、プレートには錫が0.08%しか残っていない。
電気効率の低下は、陽極の仕事が主に鉄に集中していることを示しています。鉄は受動的になり、酸素を放出して、電流効率を低下させます。
陽極残渣の色は、スズの溶出の程度を決定的に示すものでもなく、0.28%のスズでは青灰色、0.02%のスズでは赤みを帯び、0.08%では赤みを帯びたエフロレッセンスを示します。
一方、電解液が全体的または部分的に炭酸化していたり、撹拌があまり活発でない場合は、脱膜の程度はほとんど低下しませんが、端子電圧が上昇し、電流効率が低下してしまいます。
電解液中のスズの割合は2.34%を超えてはならない。そうしないと、飽和状態がアノード攻撃を妨げ、不快な結果として、不溶性の(回収できない)水和メタノール酸が形成される可能性があり、これはアノードスラッジで失われる。
アルカリ法は、酸法に比べて迅速かつ安価であるが、細心の注意を払う必要がある。酸電解液法に比べて、酸電解液法の陽極残留物は硫酸第一鉄を得るためにしか使用できないのに対し、製鉄所で非常に人気のある鋼の残留物が得られるという利点がある。
一方、酸処理では、錫がスタナスイオンとして溶液中に入るので、理論的には同じクーロン数で2倍の量の金属錫を分離できるという利点があります。
乾式塩素浸出法
浸出という言葉は、ラテン語の「Lixivia, -ae」という灰汁を意味する女性名詞に由来します。 ローマ人は、ブドウを潰す前に蒸留した果汁や、オリーブを粉砕する前に蒸留した果汁のことを指していました。 今日、浸出とは、粉砕した物質を洗浄して可溶性部分を抽出することです。
ヒギンズが提案し、パーメリー、ランボット・ゴールドミット、ウェーバーが完成させたこの方法は、乾いた塩素が錫を容易に溶かし、支持体である鋼鉄を侵すことなく塩化スズの形で分離できるため、工業的には他のすべての抽出方法を圧倒している。
Wintelerは、40~50℃に制御された温度で、切断されたブリキに乾燥塩素を作用させて塩化第一鉄を得る。この温度範囲では塩素が鉄を攻撃しないからである。これを実現するには、浸出反応器の温度が100℃を超える必要がある。見落としで塩化第二鉄ができてしまうと、冶金用語で「缶が焼けた」と言われることになる。
2Cl2 + Sn = Cl4Sn
127.25Kcal/molを放出する。 浸出工程では、高い温度上昇が発生するため、非常に困難な作業となります。 臨界点は、反応器に塩素が入ることにある。存在する塩素分子の比密度が高いため、反応したくてたまらなくなり、無水で結晶性の塩化第二鉄の軽い層が形成されることがある。この問題は、Weber J.が反応器を集中的に冷却することで、プロセスを改善し、回収缶を洗浄するための温水を得ることで解決しました。
ブリキからブリキを回収する技術は、反応器内に水分がない限り、乾燥塩素がブリキを容易に攻撃し、支持体である鉄を尊重するという特性に基づいています。十分な量の安価な乾燥塩素が入手できなければ、経済的に成り立ちません。 絹などの繊維の染色に使用される塩化第一錫と、0.1%未満のSnを含む完全に脱錫された鋼や軟鉄。 他の回収方法と比較して、乾式塩素脱脂法にはメリットしかありません。
– 提示された第1、第2のプロセスは古く、結果は不確かで、高価な設備を必要とし、回収されたスズのコストはその国の特別な条件の下でのみ価値がある。
– 酸性電解液で電気分解する場合、鉄を溶かして水素を発生させるために、供給されるエネルギー総量の50~35%が消費されるため、エネルギーの消費量が多すぎます。設備は高価で、酸性の液体を扱うものと同様に、継続的で深刻な故障にさらされるため、経済的収率は輝かず、スズは市場に出すには高すぎます。
– 基本的な電気分解は、酸の電気分解に比べて技術的にいくつかの利点があります。しかし、回収されたスズのエネルギー消費量が3,000kWh/Tmと高いため、1kWhあたりの価格では処理を維持することができず、また、あまりにも複雑な設備を必要とするため、現在の状況では、経済的なリターンを得ることができれば、経済的な奇跡と言えるでしょう。
– ブリキの端材に乾式塩素を作用させて脱錫することで、この問題をエレガントかつシンプルに解決することができた。導入力、人員、資金はほとんど必要なく、副産物は簡単な洗浄の後、何の問題もなく製鉄所に売ることができる。
液体塩素はSolvay社で製造されているので、すぐに入手できます。最も難しい問題は、安定して機能するブリキのスクラップ収集ラインを確立することです。
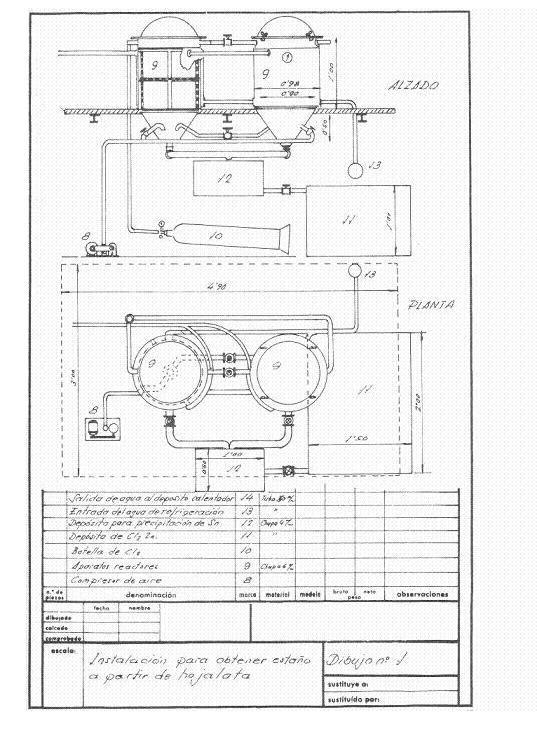
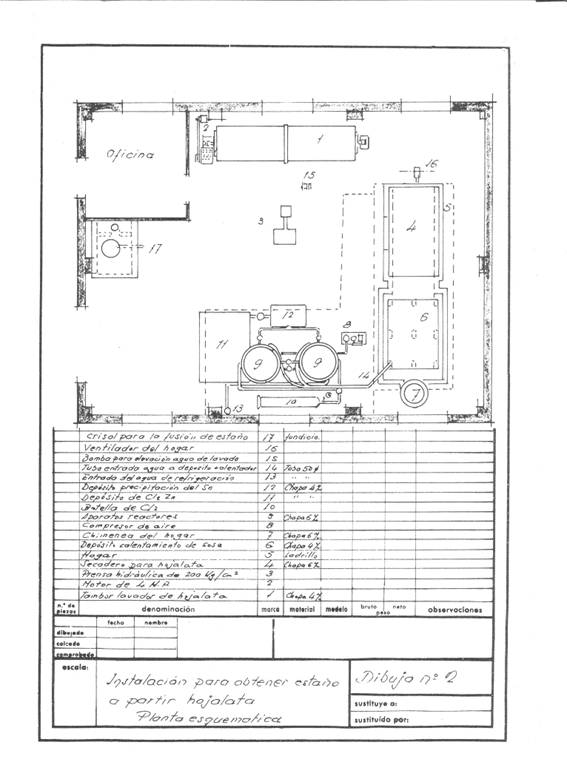
図1と図2は、計画された設備の概要を示しています。この設備は、1日あたり4トンの切りくずを回収することを想定しており、1シフトで稼働し、キャンペーンにも対応できるように設計されています。
図1:ディティニングの導入例1
図2:ディティニングの導入例2
工場に端材が搬入されると、最初の作業として、重さ2160kg、純度98%の結晶ソーダ1250kgを含む、密度11~12Beの炭酸ナトリウム溶液約2立方メートルで洗浄した。この処理は、端材に含まれる脂肪分を鹸化し、インクやニスを除去することが目的である。
鹸化とは、 脂肪酸(または脂肪酸残基を持つ鹸化可能な 脂質)と塩基または アルカリとの 化学反応であり、主な生成物はその酸と塩基の塩である。 これらの化合物は、 両性具有、つまり 極性部分と無極性部分(または非極性部分)を持っているという特徴があり、異なる性質の物質と相互作用することができる。 例えば、 石鹸はこの方法で得られた脂肪酸とアルカリ金属の塩です。 工業的な鹸化法では、大きな釜で脂肪を沸騰させ、 苛性ソーダ(NaOH)をゆっくりと加えて、ペースト状になるまで攪拌し続けます。
この作業は、容量約3.14立方メートル、洗浄面約14.13平方メートルの回転ドラムで行われ、厚さ4mmの鉄板でできており、4馬力のモーターで駆動します。
洗浄が終わると、アルカリ溶液は石鹸と一緒に、ブリキの乾燥炉の上に設置された容量約3m3のタンクにデカンテーションして保温し、使い切るまで新たな処理に再利用できるようにした。
油分、ニス、インクのない端材は、脱錫反応装置の冷却で得られた温水で洗い流される。
クリーニングされた端材は、約50kgと扱いやすい400×170×200mmの角柱状の束にして、約200kg/cm2の油圧プレスでプレスされる。
これらのパッケージは、大気圧下で約200℃の温度で2時間乾燥され、7000Kcal/kgの硬い石炭を150kg使用しています。 乾燥室は “幸運 “にも作られた乾燥棚のようなもので、中型のファンが熱風を噴射して煙突から水を引き込みます。すべては厚さ60mm、重さ280kgの85%マグネシアの層で適切に断熱されており、大気に放出する前に余分なカロリーを放出してプロセス溶液を加熱するようになっており、直径500mmの煙突はかろうじて屋根から突き出ていました。
脱錫反応器は2基直列に設置されており、都合に合わせて乾燥空気を吹き込み、終了した反応器に残っている塩素を他の反応器に渡すことで、一方が脱錫している間に、もう一方から塩化第一鉄と回収鉄を取り出すことができた。
この日、2つのリアクターには、プレスして乾燥させたスズパックが積み込まれていた。 1つ目は、乾燥した塩素を2気圧で放置。 圧力を下げて冷却水を流すと、塩素ガスが反応器の自由表面で膨張し、ブリキの中のスズに作用する。ブリキは未反応のスズがある限り継続的に塩素を吸収し、すべてのスズが塩化スズに変化すると、圧力は一定になり、アタックは終了する。 適当な時間が経過した後、装置を乾燥空気で吹き飛ばして余分な塩素を保存された反応器に吹き込み、反応器が閉じられると作動を開始し、完成した反応器からは生成された塩化第一鉄がすべて底部から吹き出され、滴下しなくなった時点で脱錫された鋼の塊を取り出し、熱い炭酸ナトリウム溶液で十分に洗浄した後、反応器からの温水で洗い流し、製鉄所にとって非常に有利な軟鋼の残渣が得られる。 このようにして、251kgの塩化第一鉄を回収し、230~240kgの塩素を消費しました。
この塩化ス タンの回収量は、115kgの金属スズを回収したことになり、回収率は96%となり、残留鉄に含まれるスズの量は0.10~0.13%となり、問題なく製鉄所に送ることができます。
溶解反応は非常に発熱性であるため、良好な収率を得るためには冷却に注意を払わなければならず、そうしないと缶が燃える危険性があります。
液体塩素は、酸素やアセチレン、二酸化炭素などと同様のスチール製ボトルで市販されており、6気圧で50kgの正味重量を持ち、1kgの液体塩素で334リットルの乾燥塩素ガスを供給することができる。
作業時間中は、1日5本のボトルを使用して4トンの挿し木を浸出しました。液体塩素は6気圧から2気圧まで膨張させましたが、これには市販の圧力調整器を使用しました。
また、当時は錫金属が不足していたため、塩化第一錫の還元プロセスも開発。 そのためには、電流を使わず、最小限の設備で電解還元を行うことを考えました。一見矛盾しているように見えますが、関連するテストを行った結果、このアイデアは決して突飛なものではなく、亜鉛とスズの間に存在する電圧差を利用する方法を開発するだけでよかったのです。 塩酸で少し酸性にした塩化第一スズの溶液(pH=5〜6)の中に亜鉛の板を入れると、次のような働きをすることがわかったのです。
Cl4Sn + 2 Zn = 2 Cl2Zn + Sn
Cl4Sn + Sn = 2 Cl2Zn
2 Cl2Sn + 2 Zn = 2 Cl2Zn + 2 Sn
その結果、亜鉛はすべて溶解し、錫はすべて金属性のスポンジ状に析出していると考えられ、これを回収して洗浄し、再溶解してインゴットを得る。
書かれた反応によると、生成した塩化スズからすべてのスズを回収するには、65kgの亜鉛が必要です。 1平方メートルあたりの重量が6.9kgの1mm厚の亜鉛板を使用したため、1日に必要な亜鉛板の量は約9.5平方メートルでした。
そのために「おみくじ」の設置を行いました。 1000×600×500mmのコンテナを作り、木枠で吊った亜鉛板を設置しました。 沈殿が終わると、木のパドルでブリキのスポンジを取り、外してお湯でよく洗い、鉄のルツボで簡単に約231.5℃で7000Kcal/kgのペレットの6~7%の石炭消費量で溶かしました。
溶解した液体を青木の枝で撹拌して脱酸素し、スラグを除去して精製した液体をインゴット型に入れて、溶接やブロンズなどの合金の製造に適した純度99.3~99.7%の金属を得た。
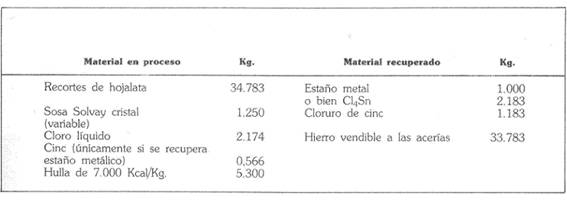
次の表は、1トンの金属を生産し、2,183kgの塩化スカンジウムに相当する場合の物質収支の概略です。






0 Comments