1. INTRODUCCIÓN: LA NATURALEZA DE LA CORROSIÓN EN ENVASES METÁLICOS
La corrosión se define técnicamente como la destrucción lenta de un metal por la acción de un agente exterior, lo que da lugar a un ataque químico o físico-químico. Aunque los metales suelen ser elementos estables, la intervención de agentes externos rompe este equilibrio. En el contexto de los envases metálicos, fundamentalmente de hojalata, este fenómeno es crítico para la integridad del producto y la seguridad alimentaria.
Todos los metales están en contacto con el aire, compuesto por un 79% de nitrógeno y un 21% de oxígeno. Dado que el nitrógeno es un gas inerte, la acción agresiva de la atmósfera sobre los metales recae casi exclusivamente en el oxígeno . Sin embargo, para que el proceso corrosivo se desencadene y progrese, el oxígeno requiere de colaboradores:
- El calor: Que junto al oxígeno atmosférico produce la oxidación superficial.
- La humedad: Que en combinación con el oxígeno produce la corrosión propiamente dicha.
2. FUNDAMENTOS ELECTROQUÍMICOS Y EL PAR GALVÁNICO
Para comprender la corrosión en envases, es imperativo entender el comportamiento electroquímico de los metales. Los metales se clasifican en función de su potencial eléctrico:
- Anódicos: Metales con potencial negativo que tienden a ceder electrones y oxidarse con facilidad.
- Catódicos: Metales con potencial positivo (como los metales nobles) que atraen iones positivos y son resistentes a la corrosión.
Cuando dos metales distintos se conectan o entran en contacto en presencia de un electrolito, se forma un Par Galvánico. En esta situación, el metal de menor potencial (el más anódico) es el que se oxida.
2.1. El Caso Específico de la Hojalata (Hierro y Estaño)
La hojalata presenta un comportamiento dual fascinante dependiendo de si la exposición es interna (sin oxígeno) o externa (con oxígeno).
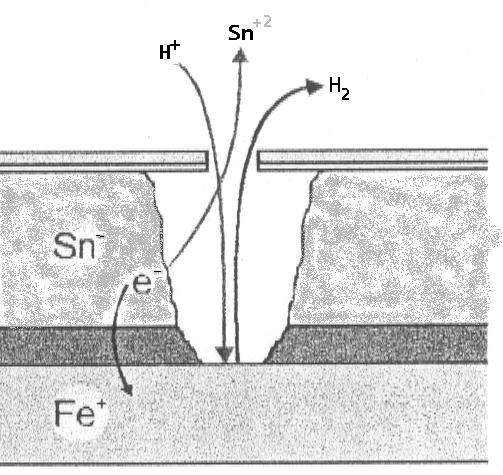
A) En el interior del envase (Ausencia de oxígeno): El estaño (Sn) actúa como ánodo frente al hierro (Fe).
- Reacción: Sn⁰ ⇔ Sn⁺² + 2e⁻ (E₀ = -0,13 V).
- Hierro: Fe⁰ ⇔ Fe⁺² + 2e⁻ (E₀ = -0,44 V).
- El estaño se oxida, protegiendo al hierro. Este fenómeno implica un desestañado, pero mantiene la integridad estructural del acero base.
B) En el exterior del envase (Presencia de oxígeno): Se produce una inversión de polaridad. El hierro se comporta como ánodo y se oxida frente al estaño, que actúa como cátodo.
- El hierro, al ser más electronegativo en este ambiente, sufre la corrosión.
- Esto da lugar a la formación de óxidos e hidróxidos de hierro (el conocido «orín» o herrumbre), cuyo color varía de amarillo a anaranjado dependiendo de la hidratación.
Las reacciones químicas de la oxidación del hierro son: Fe → Fe²⁺ + 2e⁻ (de metal a ión ferroso) Fe²⁺ → Fe³⁺ + e⁻ (de ión ferroso a férrico)
En presencia de humedad ambiental, el producto final es el óxido férrico hidratado de color naranja-rojizo: 2 Fe₂O₃ + 6H₂O → 4 Fe(OH)₃
3. CLASIFICACIÓN DE LOS TIPOS DE CORROSIÓN
La corrosión puede clasificarse en tres grandes categorías según el agente externo que la inicia.
3.1. Corrosión Electroquímica Es la más común en metales expuestos a atmósferas húmedas o sumergidos en agua. Se rige por las series galvánicas mencionadas anteriormente. Un ejemplo clásico es el comportamiento del hierro frente al zinc o al estaño:
- Frente al Zinc (Zn= -0,763 V), el hierro (Fe= -0,440 V) está protegido porque el zinc es más anódico.
- Frente al Estaño (Sn= -0,135 V), el hierro es atacado.
La presencia de sales, como el cloruro sódico (NaCl), acelera este proceso según la reacción: 2 ClNa + 2 H₂O ↔ 2 HCl + 2 NaOH La sal reacciona pero no se destruye, contribuyendo a continuar el proceso de corrosión mientras haya metal y humedad.
3.2. Corrosión Química Producida por el ataque directo de ácidos y álcalis.
- Ácidos: El hierro es atacado por ácidos no oxidantes. La presencia de azufre es particularmente peligrosa, formando sulfuro de hierro y actuando como catalizador, lo que hace riesgoso el uso de compuestos sulfurantes en envases .
- Álcalis: Atacan metales como el aluminio y el estaño. El estaño forma estannitos de sodio solubles, lo que disuelve la capa protectora hasta la destrucción total del recubrimiento .
3.3. Corrosión Microbiológica Es una de las formas menos conocidas pero altamente destructiva. Se produce por la acción de :
- Bacterias anaeróbicas: Generan metabolitos corrosivos.
- Bacterias aeróbicas: Producen ácidos minerales corrosivos.
- Hongos: Originan ácidos orgánicos metabólicos.
El metabolismo de estos microorganismos genera gases (CO₂, H₂, N₂) y sustancias como amoniaco, agua oxigenada y sulfuros, creando un microambiente altamente agresivo para el envase.
4. PROPAGACIÓN Y MORFOLOGÍA: CORROSIÓN LOCALIZADA
Aunque existe la corrosión uniforme (que afecta a toda la superficie), esta es rara en envases recubiertos. La forma más habitual en la hojalata es la corrosión localizada, que ataca zonas concretas dejando otras intactas, generalmente debido a fallos o porosidad en el recubrimiento (barniz o estaño) .
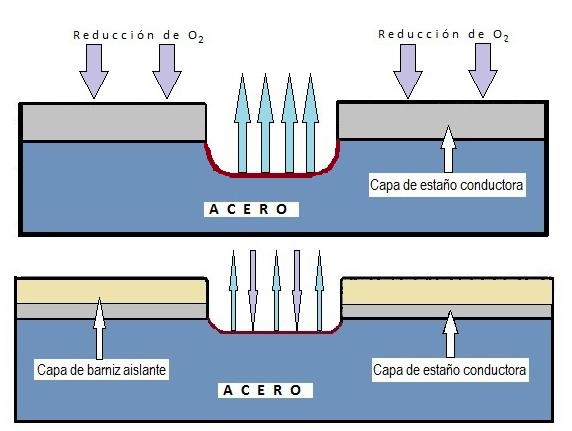
Existen varios tipos de corrosión localizada de especial relevancia:
4.1. Corrosión Intergranular Afecta a la unión de los granos en la estructura cristalina del metal, debilitando su resistencia mecánica y provocando roturas irregulares. No es la más habitual en envases .
4.2. Corrosión por Grietas o Resquicios (Crevice Corrosion) Ocurre en intersticios o zonas ocultas donde quedan estancados pequeños volúmenes de soluciones corrosivas (sales o ácidos). Es típica en los cierres de los envases o bajo las anillas de apertura fácil .
4.3. Corrosión Filiforme Esta es una variación superficial que sucede bajo recubrimientos no conductivos (barnices). Se caracteriza por formar filamentos estrechos (0,05 a 3 mm de ancho) que serpentean bajo el barniz .
- Mecanismo: Funciona por aireación diferencial. La «cabeza» del filamento es la zona anódica (donde se inicia la corrosión y hay acidificación) y la «cola» es la zona más aireada .
- Factores: Requiere una humedad relativa superior al 60% y la presencia de sales (cloruros) como iniciadores .
- Prevención: La calidad o cantidad de barniz no evita su formación; la clave es mantener la humedad baja y evitar residuos salinos .

4.4. Corrosión por Picaduras (Pitting) Es la forma más común y peligrosa de corrosión localizada. Se origina en imperfecciones o zonas mal aireadas (bajo depósitos). Su peligro radica en que perfora el metal en profundidad, a veces siendo casi invisible a simple vista desde el exterior. Las picaduras pueden adoptar diversas morfologías (estrechas y profundas, elípticas, en galerías, etc.) .
4.5. Corrosión por Stress (SCC) Implica una rotura frágil del metal debido a la combinación de tres factores simultáneos:
- Tensión por tracción (stress).
- Un medio corrosivo específico.
- Un metal susceptible .
El proceso tiene dos etapas: la formación de una grieta inicial y su propagación hasta la fractura del material. Es común observar esto en zonas de embutición profunda o en los remaches de las tapas de fácil apertura .
4.6. Daño por Hidrógeno Causado por la difusión de hidrógeno en el metal, a menudo acelerada por iones sulfurados provenientes de la descomposición de proteínas (tioproteínas) en el alimento . Reacción básica: 2 H⁺ + 2 e⁻ → H₂↑
5. FACTORES DEL PROCESO DE FABRICACIÓN Y ENVASADO
La corrosión externa no es solo un problema de material, sino de proceso. Múltiples etapas influyen en la susceptibilidad del envase:
5.1. Daños Mecánicos y Llenado
- Líneas de alimentación: Los roces y choques dañan el barniz exterior, exponiendo el acero base.
- Cierre: Es crítico el ajuste de las cerradoras. Rulinas mal engrasadas o mandriles no ajustados pueden dañar el recubrimiento en la zona del cierre.
- Llenado: Restos de producto sobre el envase contaminan el agua de esterilización, aumentando su agresividad.
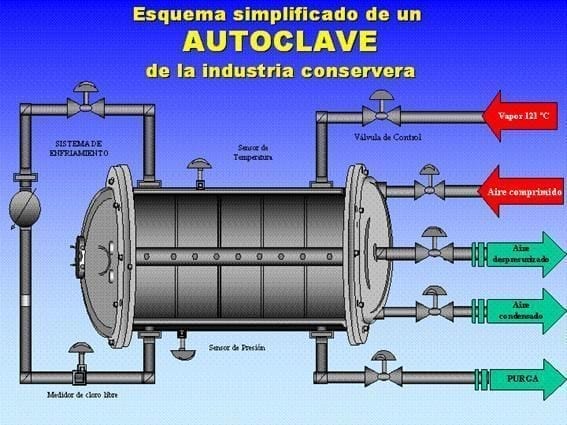
5.2. Esterilización y Enfriamiento Durante el tratamiento térmico en autoclave:
- Se aconseja usar separadores entre capas para evitar roces en caliente.
- El aire utilizado para la contrapresión aporta oxígeno corrosivo.
- La introducción directa de vapor puede arrastrar condensados alcalinos de las calderas que atacan el barniz.
- Secado: Es fundamental que la temperatura final del envase permita el «autosecado». La humedad remanente en la cubeta de la tapa o bajo la anilla es un caldo de cultivo para pilas galvánicas.
6. CALIDAD DEL AGUA: UN FACTOR DETERMINANTE
El agua de proceso (esterilización y enfriamiento) puede ser corrosiva o incrustante. Parámetros clave a controlar :
- pH: Medios ácidos o muy alcalinos atacan metal y barniz. Rango ideal: 6,5 – 8,5.
- Conductividad: Valores altos (< 2000 µS/cm recomendados) favorecen el flujo de corriente en las pilas galvánicas.
- Cloruros y Sulfatos: Deben mantenerse por debajo de 25 mg/l.
- Residuo Seco (TDS): Menor a 500 mg/l.
6.1. Índices de Evaluación del Agua Para predecir el comportamiento del agua se utilizan índices específicos:
A) Índice de Langelier (LSI): Evalúa el equilibrio del carbonato cálcico. Fórmula: LSI = pH – pHs
- Un LSI negativo (< -0,4) indica agua corrosiva.
- Un LSI positivo (> 0,2) indica agua incrustante (precipitante).
B) Índice de Ryznar (RSI): Fórmula: RSI = 2(pHs) – pH
- Valores >> 7 u 8 indican alta corrosividad.
- Valores << 6 indican tendencia a incrustaciones .
Las incrustaciones (manchas blancas de carbonatos) no son solo un problema estético; actúan como zonas de retención de humedad, favoreciendo la corrosión posterior.
6.2. Tratamientos de Pasivación Para mitigar la agresividad del agua, se añaden inhibidores catódicos (pasivantes) basados en zinc y ácido fosfórico. Estos crean una fosfatación superficial sobre el acero que lo protege. Es vital controlar la dosis, pues un exceso aumenta la conductividad y, paradójicamente, la agresividad del agua .
7. ALMACENAMIENTO Y TRANSPORTE: CONTROL AMBIENTAL
Una vez fabricado y procesado, el envase sigue en riesgo. La corrosión externa durante el almacenamiento y transporte suele deberse a la condensación y la presencia de sales higroscópicas.
7.1. Condiciones de Bodega
- Humedad Relativa (HR): Debe mantenerse baja (por debajo del 60% para evitar corrosión filiforme).
- Temperatura: Evitar cambios bruscos que lleven al punto de rocío y condensación.
- Salinidad: Los depósitos salinos atraen humedad del ambiente (higroscopicidad), iniciando corrosión.
- Materiales de embalaje: El cartón y los separadores no son inertes; deben analizarse para asegurar que no contengan sales agresivas. El uso de plástico continuo puede ser contraproducente si retiene la humedad interna .


7.2. El Fenómeno de la Condensación (Punto de Rocío) El riesgo de condensación depende de la relación entre temperatura y humedad relativa. Si la temperatura baja repentinamente, el exceso de vapor se condensa en agua líquida sobre los envases fríos.
Ejemplos críticos de caída de temperatura permitida antes de condensar (para aire inicial a 35ºC) :
- A 20% HR: La temperatura debe bajar 28ºC (hasta 7ºC) para condensar (Riesgo bajo).
- A 50% HR: Basta con que baje 12ºC (hasta 23ºC).
- A 75% HR: Con solo bajar 5ºC (hasta 30ºC) se produce condensación (Riesgo muy alto).
Esto es crítico en el transporte marítimo, donde los contenedores sufren grandes variaciones térmicas.
7.3. Protección contra UV La radiación ultravioleta (solar o de tubos fluorescentes en insectocutores) degrada los barnices y las litografías, debilitando la barrera protectora exterior .
8. MÉTODOS DE PROTECCIÓN Y CONCLUSIÓN
La lucha contra la corrosión se basa en la prevención. Las estrategias fundamentales incluyen:
- Mantener la integridad del barniz: Un barniz roto concentra el ataque anódico.
- Eliminar residuos higroscópicos: Limpieza exhaustiva de los envases tras el cierre.
- Secado absoluto: Evitar agua en resquicios (cierres, anillas).
- Control ambiental: Almacenes secos, ventilados y con control de temperatura para evitar el punto de rocío .
- Uso de inhibidores: Tratamiento químico del agua de proceso (pasivación).
En conclusión, la corrosión en envases metálicos es un fenómeno multifactorial que involucra química, metalurgia y física atmosférica, cuyo control depende de la gestión integral de todo el ciclo de vida del envase.