SOMMARIO
Descrizione di vari procedimenti industriali per il recupero dello stagno contenuto nei ritagli di banda stagnata scartati dall’industria metallurgica. Da essi si può dedurre che quello veramente interessante è quello che ottiene questo stagno con un processo a secco per lisciviazione con cloro.
INTRODUZIONE
Lo stagno è il componente più specifico della banda stagnata, che le conferisce la sua caratteristica principale: la resistenza alla corrosione sotto l’azione di elementi esterni. È un metallo di alto prezzo nel mercato, poiché il suo ottenimento dal minerale, oltre ad essere costoso, è molto controllato dalle grandi multinazionali che cercano di mantenere il prezzo elevato e la scarsità di offerta di fronte a una domanda significativa. Per questo motivo, in certi periodi e in certe zone geografiche, è spesso interessante considerare il recupero di questo metallo dai ritagli di banda stagnata scartati dalle fabbriche di imballaggi. Perciò, riteniamo interessante riprodurre parzialmente un articolo di Pedro López Gómez pubblicato con il titolo “IL RECUPERO DELLA CANNELLA DALLA POLPA DEL PIAZZATORE” nella rivista “Técnica Industrial”.
“Il contenuto di stagno nella banda stagnata è variabile e va dal 2% nella lamiera spessa al 4,5% nella lamiera sottile. Come criterio generale, le talee che non contengono almeno il 2% di stagno non possono beneficiare economicamente.
Il supporto in acciaio Matin – l’anima della banda stagnata – deve essere estremamente sverniciato per poter essere riutilizzato come rottame. La presenza di stagno, anche in piccole quantità, ha una notevole influenza sulla duttilità dell’acciaio e un contenuto dello 0,3% di Sn è sufficiente a renderlo fragile e inadatto come acciaio di recupero.
Come sappiamo, la banda stagnata è formata da uno strato esterno di stagno quasi puro, facilmente separabile; sotto c’è un altro strato cristallino formato da una vera e propria lega stagno-ferro che è più difficile da separare poiché è fortemente aderente alla lamiera di supporto e difficile da attaccare.
LAVORI PRELIMINARI
Prima di applicare qualsiasi metodo di sverniciatura, è necessario pulire a fondo i ritagli di latta e rimuovere quanto più grasso, inchiostri, vernici e residui organici possibile.
A questo scopo, le confezioni perforate vengono preparate e sottoposte a una sorta di pre-fusione a bassa temperatura per rimuovere quanto più stagno possibile. Prima di questa operazione, la vernice che copre le talee deve essere rimossa. A questo scopo, la vernice si scioglie facilmente in una soda Solvay alcalina al 10% o in una liscivia caustica; se si osservano residui di smalto, i pacchetti di banda stagnata vengono passati attraverso una calandra a rulli disposta in modo che uno dei cilindri lavori a una velocità maggiore dell’altro, causando così l’ondulazione del pacchetto e il distacco dello smalto.
Esistono in commercio attrezzature come la “Goldschmidt TH”, che pressa e perfora i ritagli con cilindri chiodati, e saponifica i grassi e le vernici con un trattamento di liscivia di sodio al 3% per quindici-trenta minuti in autoclave a 110-115º C, poi lava con acqua calda per eliminare saponi e residui di liscivia e poi riscalda per mezz’ora a 500º C per recuperare lo strato esterno di stagno, distruggendo così la materia organica – gomme di tenuta – e li pressa di nuovo.
In questa operazione ha fatto molta attenzione a non formare galli di materia organica, che avrebbero poi ostacolato la penetrazione degli agenti svernicianti.
I processi di de-tinning conosciuti possono essere classificati in quattro gruppi principali:
a) – Processi chimici umidi.
b) – Processi metallurgici a secco
c) – Processi elettrolitici mediante soluzione in acidi o alcali.
d) – Processi che utilizzano cloro secco
Guarderemo ognuno di loro di seguito.
PROCESSI CHIMICI UMIDI
Per molto tempo il recupero dello stagno dalla banda stagnata è stato tentato utilizzando processi chimici di soluzioni acide, alcaline o saline, rinunciando a continuare il suo uso per avere basse rese in ogni occasione.
Kecth e Hette iniziarono su questa strada in vista di una successiva elettrolisi; ma Goldsch-Midt dimostrò che quando lo stagno viene dissolto dagli acidi, il ferro, che è difficile e costoso da separare, viene dissolto allo stesso tempo. Gli alcali da soli o con l’aggiunta di agenti ossidanti non attaccano il ferro, ma non rimuovono completamente nemmeno lo stagno, per cui la lamiera non può essere utilizzata nemmeno industrialmente.
Schulze tratta la banda stagnata con una soluzione di cloruro stannoso che dissolve lo stagno metallico per ridurlo a sale stannoso:
Cl4Sn + Sn = 2 Cl2Sn
E poi passa il vapore acqueo, che precipita l’ossicloruro stannoso e rigenera il cloruro stannoso, che ritorna nel ciclo:
6 Cl2Sn + 2 H2O + O2 = 4 ClSnOH + 2 Cl4Sn
Il ClSnOH separato viene filtrato e trasformato in ossido stannico SnO2 per ossidazione rossa in presenza di aria con rilascio di cloro, che viene recuperato:
4 SnClOH + 3 O2 = 4 SnO2 + C l2 + 2 H2O
Il cloruro ferrico è stato usato anche al posto del cloruro stannico come solvente, perché se il Cl3Fe è presente in eccesso, lo stagno viene ossidato e il ferro viene ridotto:
4 Cl3Fe + Sn = Cl4Sn + 4 Cl2Fe
Quando quasi tutto il cloruro ferrico ha ossidato lo stagno a cloruro stannoso, si riduce con l’eccesso di stagno presente a cloruro stannoso.
Cl4Sn + Sn = 2 Cl2Sn
Che con il vapore acqueo si trasforma in cloruro stannoso basico e con la successiva calcinazione si otterrà l’ossido stannico e si recupererà il cloro necessario per rigenerare il cloruro ferrico per ossidazione del Cl2Fe:
2 Cl2Fe + Cl2 = 2 Cl3Fe
Che ritorna al ciclo di lisciviazione; in entrambi i casi l’ossido stannico viene ridotto a metallo in un apposito forno.
Reinecken-Ponsgenykopp tratta i rifiuti di banda stagnata in tamburi rotanti con PbO – pulce di ossido – e vapore acqueo, per cui riesce – in presenza di soda caustica aggiunta in precedenza – a formare stannato di sodio SnO3Na2.3H2O e a separare il piombo metallico.
Lo stannato di sodio può essere immesso sul mercato in forma concentrata o cristallizzata, o in un’operazione successiva lo stagno può essere precipitato per mezzo di una corrente gassosa di anidride carbonica e successiva riduzione in un forno a riverbero.
PROCESSI METALLURGICI A SECCO
Questo processo si riduce a una separazione dello stagno per fusione e ossidazione, in parte a “ceneri di stagno”, che sono ridotte in un forno riverberatore o dissolte in metalli fusi, o a formare direttamente dei sali o a utilizzare il metallo per semplice fusione e separazione meccanica delle goccioline di stagno liquido.
Per esempio, Laroque mescola i rifiuti di banda stagnata con carbone di legna – che non ha quasi nessuna cenere – e cloruro di sodio, e Edmunds fonde i ritagli di banda stagnata a una temperatura sufficiente per liquefare lo stagno in una centrifuga dotata di un focolare speciale nel suo centro, dove le gocce di stagno fuso sono separate dalla forza centrifuga.
Wolterez tratta i rifiuti di banda stagnata in storte con vapore riscaldato a 450-500º C, per separare lo stagno dal ferro per fusione; in queste condizioni lo stagno non si ossida perché è esposto all’azione riducente dell’idrogeno prodotto dalla riduzione del vapore sul ferro riscaldato; solo una debole pellicola di ossido può essere rilevata, e non spesso, sullo strato esterno dello stagno liquido; Sono stati provati anche processi che fanno agire il sodio fuso sui tagli di banda stagnata; hanno il vantaggio di sciogliere completamente lo stagno, lasciando un taglio di acciaio in ottime condizioni in modo che con una semplice forgiatura possa essere utilizzato di nuovo, ma il processo è complicato, fastidioso e pericoloso, come si può dedurre dall’andamento del processo che stiamo descrivendo a grandi linee: una serie di depositi stagni e collegati convenientemente con tubi, il tutto era costruito in acciaio e funzionava come uno scarico; in testa si introducevano i ritagli di banda stagnata insieme a sodio puro o lega sodio-stagno; una volta chiuso ermeticamente l’apparecchio veniva riscaldato a 400-500º C in un forno a gas; si faceva il vuoto e si agitava il contenuto, in modo che lo stagno si dissolvesse in circa quindici minuti: Continuando la lisciviazione in un ciclo continuo, si raggiunge una lega 50/50; ora non resta che recuperare il sodio per distillazione per ottenere lo stagno.
PROCESSI ELETTROLITICI
All’inizio si lavorava con elettroliti acidi: acido solforico, solfato acido di sodio e cloruri; con questo tipo di elettroliti le rese erano basse e fu presto abbandonato. Oggi si usa solo l’elettrolita di base, ma daremo una piccola idea di come veniva usato in passato.
Gutensonn lavorava con un elettrolita di acido solforico al 10% riscaldato a 60ºC. Formò l’anodo con i pacchi di banda stagnata posti in cesti di legno di 1200 x 300 x 800 mm. cioè con un volume di 0,288 metri cubi, mentre i bagni di circa un metro cubo di capacità furono costruiti con legno di pino o faggio di 50 mm di spessore, ricoperti con 3,5 mm di spessore di gomma compressa. I catodi sono stati formati con fogli di rame stagnato di 1200 x 0,50 x 1,5 mm; in ogni bagno c’erano otto scatole anodiche e 16 scatole catodiche distanti 100 mm. Le caratteristiche di lavoro erano 240 A, 15 V che teoricamente dovrebbero separare 4,15 kg. di stagno all’ora, ma la resa pratica raggiungeva a malapena il 45% perché il resto della corrente veniva spesa per sciogliere il ferro e rilasciare idrogeno, in modo da ottenere uno stagno piuttosto puro.
Nel processo alcalino l’elettrolita è il 10% di NaOH, il resto rimane; ora lo stagno va in soluzione come stannato di sodio di formula SnO3Na2, molto solubile, che precipita come metallo sul catodo.
La precipitazione è più lenta della dissoluzione, per cui l’elettrolita si arricchisce gradualmente di stagno, anche se con velocità decrescente.
Un nemico particolare dell’efficienza in corrente è l’avidità della soda sodica dell’elettrolita per l’anidride carbonica atmosferica; quando l’NaOH carbonata, perde attività di dissoluzione e conducibilità elettrica, il che impone l’obbligo di rinnovare troppo spesso l’elettrolita per eliminare il carbonato di sodio formato e le impurità dissolte nell’anodo per causticizzazione; è conveniente mescolare frequentemente l’elettrolita in modo che l’anodo ceda solo ioni stannosi.
La temperatura di lavoro è di circa 70º C con una densità anodica di 18 A/m2 e 100 A/m2 nella regione catodica, così che se l’elettrolita contiene il 10% di alcali liberi, l’efficienza della corrente anodica è del 94-95%. Se l’elettrolisi si ferma improvvisamente, gli ioni stannosi scompaiono e c’è un aumento immediato della tensione terminale di circa 0,7-1,2 V.
Ora, con ogni probabilità, inizia la de-stagionatura della lega ferro-stagno; la tensione aumenta rapidamente a 1,8 V e solo lo 0,08% di stagno rimane nel foglio, cioè circa il 2,40% della quantità totale da recuperare; l’efficienza della corrente è ora dell’88-89%, che diminuisce all’82-83% quando la tensione aumenta a 2,5 V e solo lo 0,02% di Sn rimane da recuperare, che rappresenta lo 0,05-0,06% della quantità contenuta principalmente nel ritaglio.
La diminuzione dell’efficienza elettrica mostra che il lavoro anodico si concentra principalmente sul ferro; esso diventa passivo e rilascia ossigeno, il che riduce l’efficienza della corrente.
Il colore del residuo anodico non è determinante né indicativo del grado di lisciviazione dello stagno; se con un contenuto di 0,28% di Sn è grigio bluastro e con 0,02% di Sn rossastro, già con 0,08% mostra efflorescenze rossastre.
D’altra parte, se l’elettrolita è totalmente o parzialmente carbonato o l’agitazione non è molto vigorosa, il grado di de-tintura diminuisce poco, ma la tensione terminale aumenta e l’efficienza della corrente diminuisce.
La percentuale di stagno nell’elettrolita non deve essere superiore al 2,34%; altrimenti la saturazione ostacola l’attacco anodico e come conseguenza spiacevole si può formare acido metanolico idrato insolubile – non recuperabile – che si perde nel fango anodico.
Il processo alcalino è più veloce ed economico di quello acido e richiede molta vigilanza. Il vantaggio rispetto al metodo con elettrolita acido è che produce un residuo siderurgico che è molto popolare nelle acciaierie, mentre il residuo anodico del processo che lavora con elettrolita acido può essere utilizzato solo per ottenere solfato ferroso.
Il processo acido ha, d’altra parte, il vantaggio che lo stagno va in soluzione come ione stannoso, così che teoricamente con la stessa quantità di coulombs si dovrebbe separare il doppio dello stagno metallico.
PROCESSO DI LISCIVIAZIONE CON CLORO SECCO
La parola lisciviazione deriva dal latino: “Lixivia, -ae” sostantivo femminile che significa liscivia. I romani usavano questo termine per indicare i succhi distillati dall’uva prima di schiacciarla, o le olive prima di macinarle. Oggi, la lisciviazione è il lavaggio di una sostanza polverizzata per estrarre le parti solubili.
Proposto da Higgins e perfezionato da Parmelee, Lambotte Goldsmitd e Weber, ha spazzato industrialmente gli altri metodi di estrazione perché il cloro secco dissolve facilmente lo stagno e permette di separarlo sotto forma di cloruro stannico senza attaccare l’acciaio di supporto; la Germania recupera con questo processo più dell’85% della produzione di ritagli.
Winteler ottiene il cloruro stannico facendo lavorare il cloro secco sulla banda stagnata in tagli a una temperatura controllata di 40-50º, poiché in questo intervallo di temperatura il cloro non attacca il ferro; perché ciò avvenga è necessario che la temperatura nel reattore di lisciviazione superi i 100º C; se per una svista si forma cloruro ferrico, si dirà in termini metallurgici che lo “stagno è stato bruciato”; bisogna considerare che la reazione:
2Cl2 + Sn = Cl4Sn
Rilascia 127,25 Kcal/mol. di cloruro stannico formato, che può annullare le prestazioni di lisciviazione a causa dell’aumento di temperatura che si verifica. Il punto critico è centrato sull’entrata del cloro nel reattore; a causa dell’alta densità specifica delle moli di cloro presenti, desiderose di reagire, si può formare un leggero strato di cloruro ferrico anidro e cristallino, che per la sua igroscopicità assorbe l’umidità dell’involucro e da questo momento la dissoluzione del ferro sotto forma di tricloruro di ferro può manifestarsi con enorme velocità in tutto il foglio; questo problema fu risolto da Weber J. raffreddando intensamente il reattore, migliorando così il processo e ottenendo acqua calda per il lavaggio della lattina recuperata.
La tecnica per il recupero dello stagno dalla banda stagnata si basa sulla proprietà del cloro secco di attaccare facilmente lo stagno e di rispettare il ferro di supporto finché non c’è traccia di umidità nel reattore; economicamente non può essere praticabile se non sono disponibili quantità sufficienti di cloro secco a buon mercato e con questo processo in una sola operazione si ottengono contemporaneamente i due componenti della banda stagnata. Da un lato, il cloruro stannico di grande valore per la sua applicazione nella tintura delle fibre tessili – seta, ecc. – e dall’altro, l’acciaio o il ferro dolce perfettamente sverniciato con meno dello 0,1% di Sn. Rispetto agli altri metodi di recupero, il processo di de-tinizzazione del cloro secco ha solo vantaggi:
– Il primo e il secondo processo presentati sono antiquati, di risultati incerti, richiedono installazioni costose e il costo dello stagno recuperato è compensato solo in condizioni speciali di un paese.
– Nell’elettrolisi con elettrolita acido si consuma troppa energia, poiché il 50-35 % della quantità totale di farine fornite si consuma nel lavoro di dissoluzione del ferro e generazione di idrogeno; gli impianti sono costosi, molto esposti a subire continui e gravi guasti come tutti quelli che lavorano con liquidi acidi, per cui il rendimento economico non è brillante e lo stagno è troppo costoso per essere messo sul mercato.
– L’elettrolisi dell’elettrolita basico presenta alcuni vantaggi tecnici rispetto a quella dell’elettrolita acido; tuttavia, il suo elevato consumo energetico – 3.000 kWh/Tm – di stagno recuperato non sostiene il trattamento al prezzo al quale viene fatturato il kWh e poiché richiede un’installazione troppo complessa, allo stato attuale delle cose, sarebbe un clamoroso miracolo che possa dare un ritorno economico.
– La stagnatura per azione del cloro secco sui ritagli di banda stagnata risolve elegantemente e semplicemente il problema; richiede poca forza installata, poco personale, poca immobilizzazione monetaria e il sottoprodotto può essere venduto alle acciaierie senza alcun problema dopo un semplice lavaggio.
Il cloro liquido si può trovare senza molte difficoltà – è prodotto dalla Solvay y Cia – il problema più difficile è stabilire una linea congruente e ben funzionante per la raccolta dei ritagli di latta.
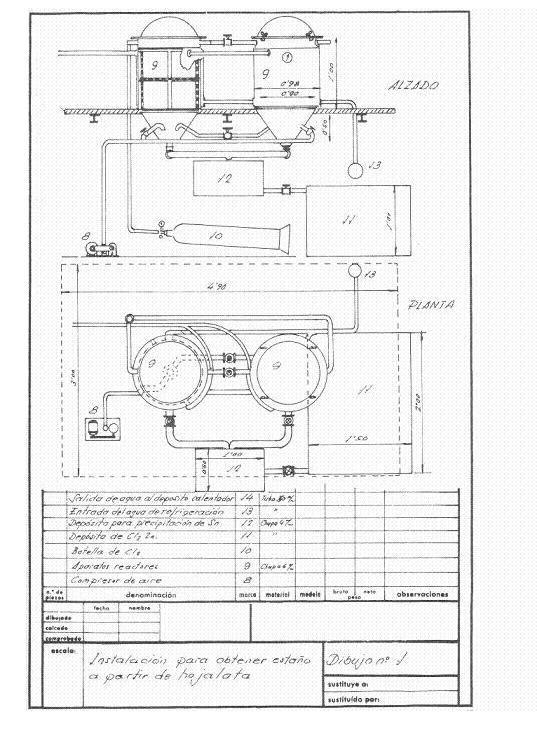
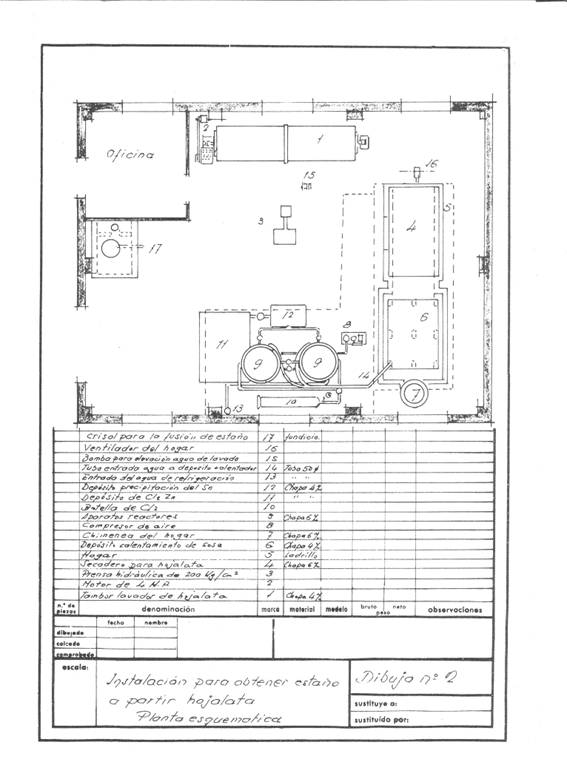
Le figure 1 e 2 danno un’idea dell’installazione che è stata progettata; è stato pensato per avere una frequenza di recupero di 4 tonnellate di ritagli al giorno lavorando in un turno e pensato per lavorare in campagne.
Figura n. 1: Esempio 1 di installazione di de-tinning
Figura n. 2: Esempio di 2a installazione di stagnatura
Quando i ritagli sono stati ricevuti nello stabilimento, la prima operazione è stata quella di lavarli con circa 2 metri cubi di una soluzione di carbonato di sodio di densità 11-12 Be, che pesa 2160 kg e contiene 1250 kg di soda cristallina – purezza 98% -, trattamento la cui missione è quella di saponificare i rifiuti grassi che i ritagli possono contenere e di rimuovere inchiostri e vernici.
La saponificazione è una reazione chimica tra un acido grasso (o un lipide saponificabile, che porta residui di acido grasso) e una base o un alcali, in cui il principale prodotto ottenuto è il sale dell’acido e della base. Questi composti hanno la particolarità di essere anfipatici, cioè hanno una parte polare e una apolare (o non polare), per cui possono interagire con sostanze di proprietà diverse. Per esempio, i saponi sono sali di acidi grassi e metalli alcalini ottenuti con questo processo. Il metodo di saponificazione nell’aspetto industriale consiste nel far bollire il grasso in grandi bollitori, aggiungendo lentamente la soda caustica (NaOH), mescolando continuamente la miscela fino a quando non comincia a diventare pastosa.
Questa operazione si realizza in un tamburo rotante con una capacità di circa 3,14 metri cubi e utilizza una superficie di lavaggio di circa 14,13 m2, costruito in lamiera di ferro di 4 mm di spessore e azionato da un motore di 4 HP.
Una volta terminata l’operazione di lavaggio, la soluzione alcalina veniva travasata insieme ai saponi in una vasca di circa 3 m3 di capacità, situata sopra il forno di asciugatura della banda stagnata per mantenerla calda e poterla utilizzare nuovamente in nuovi trattamenti fino al suo esaurimento.
I ritagli privi di grasso, vernice e inchiostro vengono sciacquati con acqua calda, generosamente ottenuta dal raffreddamento dei reattori di stagnatura.
I ritagli puliti vengono pressati in pacchetti prismatici di 400 x 170 x 200 mm, facilmente gestibili, dato che pesano circa 50 kg, in una pressa idraulica a circa 200 kg/cm2.
Questi pacchetti vengono essiccati sotto pressione atmosferica a circa 200º C per due ore, con un consumo medio di 150 kg di carbone a 7000 Kcal/kg. La camera di essiccazione era una specie di essiccatoio a ripiani – senza molta entità – costruito di “fortuna”, dove un ventilatore medio iniettava l’aria calda per trascinare l’acqua attraverso il camino: il tutto era convenientemente isolato con uno strato di magnesia 85%, di 60 mm di spessore e 280 kg di peso, e prima di mandarlo nell’atmosfera veniva fatto cedere le calorie in eccesso per riscaldare le soluzioni di processo, il camino di 500 mm di diametro sporgeva appena dal tetto.
I reattori di de-tintura erano due in serie, e l’aria secca poteva essere soffiata in loro a convenienza per passare il cloro rimanente dal reattore finito all’altro, in modo che mentre uno era de-tintura, il cloruro stannico e l’acciaio recuperato venivano estratti dall’altro.
All’inizio della giornata i due reattori sono stati caricati con i pacchi di latta pressati ed essiccati. Nel primo, il cloro secco è stato lasciato a 2 atm. Quando si riduce la pressione e si lascia scorrere l’acqua di raffreddamento, il cloro gassoso si espande sulla superficie libera del reattore e agisce sullo stagno nella latta; questo assorbe continuamente cloro finché c’è stagno non reagito, e quando tutto lo stagno è stato trasformato in cloruro stannico, la pressione rimane costante e l’attacco termina. Dopo un adeguato intervallo di tempo l’apparecchio viene soffiato con aria secca per portare via l’eccesso di cloro nel reattore conservato, che una volta chiuso inizia a lavorare, mentre dal reattore finito tutto il cloruro stannico formatosi viene soffiato fuori attraverso il fondo, e quando non gocciola più la massa di acciaio sverniciato viene tolta, lavata bene con soluzione calda di carbonato di sodio, poi risciacquata con l’acqua calda del reattore e si ottiene un residuo di acciaio dolce molto vantaggioso per le acciaierie. Lavorando in questo modo abbiamo recuperato 251 kg di cloruro stannico e consumato 230-240 kg di cloro.
Questa cifra di cloruro stannico recuperato rappresenta un recupero di 115 kg di stagno metallico, cioè una resa di recupero del 96%, per cui il ferro residuo contiene solo lo 0,10-0,13% di stagno, il che permette di inviarlo alle acciaierie senza problemi.
Poiché la reazione di dissoluzione è molto esotermica, il raffreddamento deve essere attentamente controllato per ottenere una buona resa: altrimenti c’è un certo rischio di bruciare la lattina.
Il cloro liquido è disponibile in commercio in bottiglie d’acciaio simili a quelle di ossigeno, acetilene, anidride carbonica, ecc.; contengono 50 kg di peso netto a 6 atm e ogni chilogrammo di cloro liquido fornisce 334 litri di cloro secco.
Durante il tempo di lavoro abbiamo usato 5 bottiglie al giorno per lisciviare i 4 Tm di tagli; abbiamo lasciato espandere il cloro liquido da 6 a 2 atm, per cui abbiamo usato un regolatore di pressione commerciale.
Poiché lo stagno metallico scarseggiava in quel periodo, abbiamo anche sviluppato un processo di riduzione del cloruro stannico. Per fare questo abbiamo pensato di avviare una riduzione elettrolitica senza dispendio di corrente e con un’installazione minima; sembra una contraddizione, ma dopo le relative prove, l’idea non era irragionevole, dovevamo solo sviluppare un uso della differenza di tensione esistente tra zinco e stagno. Studiando il problema siamo arrivati a una certezza: abbiamo visto che una lastra di zinco introdotta in una soluzione di cloruro stannico leggermente acidificato con acido cloridrico (pH=5-6), ha realizzato i seguenti lavori:
Cl4Sn + 2 Zn = 2 Cl2Zn + Sn
Cl4Sn + Sn = 2 Cl2Zn
2 Cl2Sn + 2 Zn = 2 Cl2Zn + 2 Sn
Questo porta alla considerazione che tutto lo zinco è dissolto e tutto lo stagno precipita in una forma spugnosa di carattere metallico, che viene raccolta, lavata e rifusa per ottenere il lingotto.
Secondo le reazioni scritte, sono necessari 65 kg di zinco per recuperare tutto lo stagno dal cloruro stannico formato. Stavamo usando lastre di zinco di 1 mm di spessore che hanno un peso per metro quadrato di 6,9 kg e quindi avevamo bisogno di circa 9,5 metri quadrati di lastre di zinco al giorno.
Abbiamo fatto un’installazione “fortuna” per questo. Abbiamo costruito un contenitore di 1000 x 600 x 500 mm e vi abbiamo collocato delle lastre di zinco sospese a dei telai di legno. Una volta finita la precipitazione abbiamo preso la spugna di stagno con palette di legno, le abbiamo tolte e lavate bene con acqua calda e le abbiamo fuse in un crogiolo di ferro facilmente a 231,5º C con un consumo di carbone del 6-7 % di un pellet di 7000 Kcal/kg.
Una volta fuso, il liquido veniva rimosso per mezzo di rami di legno verde per disossidare; le scorie venivano rimosse e il liquido purificato veniva introdotto in lingottiere, ottenendo così un metallo con una purezza dal 99,3 al 99,7 % adatto alla saldatura e alla fabbricazione di bronzi e altre leghe.
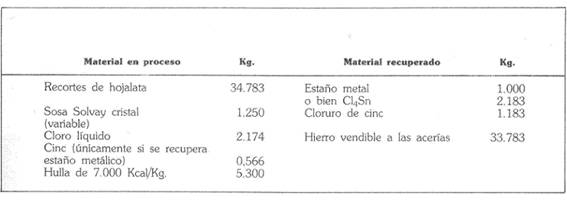
La seguente tabella è un breve bilancio materiale dell’operazione, stabilito per una produzione di una tonnellata di metallo, equivalente a 2.183 kg di cloruro stannico”.













0 Comments