ZUSAMMENFASSUNG
Beschreibung verschiedener industrieller Verfahren zur Rückgewinnung von Zinn, das in den von der metallurgischen Industrie verworfenen Weißblechabfällen enthalten ist. Aus ihnen lässt sich ableiten, dass die wirklich interessante diejenige ist, die dieses Zinn in einem trockenen Verfahren durch Auslaugen mit Chlor gewinnt.
EINLEITUNG
Zinn ist der spezifischste Bestandteil von Weißblech, der ihm seine Haupteigenschaft verleiht: seine Korrosionsbeständigkeit unter der Einwirkung von äußeren Elementen. Es ist ein Metall mit hohem Preis auf dem Markt, da seine Gewinnung aus dem Erz, abgesehen davon, dass es teuer ist, sehr von großen multinationalen Unternehmen kontrolliert wird, die versuchen, den hohen Preis und die Knappheit des Angebots angesichts der großen Nachfrage aufrechtzuerhalten. Aus diesem Grund ist es zu bestimmten Zeiten und in bestimmten geografischen Gebieten oft interessant, die Rückgewinnung dieses Metalls aus ausrangierten Weißblechabschnitten von Verpackungsfabriken zu betrachten. Daher halten wir es für interessant, einen Artikel von Pedro López Gómez auszugsweise wiederzugeben, der in der Zeitschrift „Técnica Industrial“ unter dem Titel „DIE RÜCKGEWINNUNG VON STANNISCH AUS DEM PITCHERPULP“ veröffentlicht wurde.
„Der Zinngehalt in Weißblech ist variabel und reicht von 2 % bei dickem Blech bis zu 4,5 % bei dünnem Blech. Als allgemeines Kriterium gilt, dass Stecklinge, die nicht mindestens 2 % Zinn enthalten, nicht wirtschaftlich genutzt werden können.
Der Matin-Stahlträger – der Kern des Weißblechs – muss extrem entzinnt werden, damit er als Schrott wiederverwendet werden kann. Das Vorhandensein von Zinn, selbst in geringen Mengen, hat einen erheblichen Einfluss auf die Duktilität des Stahls und ein Gehalt von 0,3 % Sn reicht aus, um ihn spröde und als Bergungsstahl ungeeignet zu machen.
Wie wir wissen, besteht Weißblech aus einer äußeren Schicht aus fast reinem Zinn, die sich leicht abtrennen lässt; darunter befindet sich eine weitere kristalline Schicht aus einer echten Zinn-Eisen-Legierung, die schwieriger abzutrennen ist, da sie stark mit dem Trägerblech verklebt ist und nur schwer angegriffen werden kann.
VORARBEITEN
Vor der Anwendung jeder Verzinnungsmethode ist es notwendig, die Weißblechabschnitte gründlich zu reinigen und so viel Fett, Farben, Lacke und organische Rückstände wie möglich zu entfernen.
Zu diesem Zweck werden perforierte Verpackungen vorbereitet und einer Art Vorschmelzen bei niedriger Temperatur unterzogen, um so viel Zinn wie möglich zu entfernen. Vor diesem Vorgang muss der Lack, der die Stecklinge bedeckt, entfernt werden. Zu diesem Zweck wird der Lack leicht in einer 10%igen alkalischen Solvay-Soda oder Lauge aufgelöst; wenn Emaille-Rückstände beobachtet werden, werden die Weißblechpakete durch einen Walzenkalander geführt, der so angeordnet ist, dass einer der Zylinder mit einer höheren Geschwindigkeit arbeitet als der andere, wodurch das Paket gewellt wird und die Emaille sich löst.
Auf dem Markt gibt es Geräte wie den „Goldschmidt TH“, der die Verschnitte mit Stachelzylindern presst und perforiert und die Fette und Lacke mit einer 3%igen Natronlauge fünfzehn bis dreißig Minuten lang in einem Autoklaven bei 110-115º C verseift, dann mit heißem Wasser wäscht, um Seifen- und Laugenreste zu beseitigen, und dann eine halbe Stunde lang bei 500º C erhitzt, um die äußere Zinnschicht zurückzugewinnen, wodurch die organischen Stoffe – die Siegelgummis – zerstört werden, und sie erneut presst.
Dabei hat er sehr darauf geachtet, dass sich kein Schwanz der organischen Substanz bildet, der später das Eindringen der Entkonservierungsmittel behindern würde.
Die bekannten Entzinnungsprozesse lassen sich in vier Hauptgruppen einteilen:
a) – Nasschemische Verfahren.
b) – Trockenmetallurgische Prozesse
c) – Elektrolytische Verfahren mittels Lösung in Säuren oder Laugen.
d) – Verfahren mit trockenem Chlor
Im Folgenden werden wir uns jede einzelne von ihnen ansehen.
NASSCHEMISCHE VERFAHREN
Lange Zeit wurde die Rückgewinnung von Zinn aus Weißblech mit chemischen Verfahren aus sauren Lösungen, Laugen oder Salzlösungen versucht, aber wegen der jeweils geringen Ausbeute wieder verworfen.
Kecth und Hette begannen diesen Weg mit Blick auf eine spätere Elektrolyse; aber Goldsch-Midt zeigte, dass bei der Auflösung von Zinn durch Säuren gleichzeitig das schwer und teuer abzutrennende Eisen aufgelöst wird. Alkalien allein oder mit Zusatz von Oxidationsmitteln greifen das Eisen nicht an, entfernen aber auch das Zinn nicht vollständig, so dass das Stahlblech auch nicht industriell verwendet werden kann.
Schulze behandelt Weißblech mit Zinnchloridlösung; sie löst metallisches Zinn auf und reduziert es zu Zinnsalz:
Cl4Sn + Sn = 2 Cl2Sn
Und dann passiert Wasserdampf, der Zinn(II)-Oxychlorid ausfällt und Zinn(II)-chlorid regeneriert, das in den Kreislauf zurückkehrt:
6 Cl2Sn + 2 H2O + O2 = 4 ClSnOH + 2 Cl4Sn
Das abgetrennte ClSnOH wird filtriert und durch Rot-Oxidation in Gegenwart von Luft unter Freisetzung von Chlor in Zinnoxid SnO2 umgewandelt, das zurückgewonnen wird:
4 SnClOH + 3 O2 = 4 SnO2 + C l2 + 2 H2O
Außerdem wurde Eisenchlorid anstelle von Zinnsäurechlorid als Lösungsmittel verwendet, da bei einem Überschuss an Cl3Fe das Zinn oxidiert und das Eisen reduziert wird:
4 Cl3Fe + Sn = Cl4Sn + 4 Cl2Fe
Wenn das Eisenchlorid das Zinn fast vollständig zu Zinnchlorid oxidiert hat, wird es mit dem vorhandenen Zinnüberschuss zu Zinnchlorid reduziert.
Cl4Sn + Sn = 2 Cl2Sn
Das wird mit Wasserdampf in basisches Zinn(II)-chlorid umgewandelt und durch anschließende Kalzinierung erhalten wir Zinn(II)-oxid und gewinnen das Chlor zurück, das zur Regeneration des Eisen(III)-chlorids durch Oxidation von Cl2Fe notwendig ist:
2 Cl2Fe + Cl2 = 2 Cl3Fe
Womit wir wieder beim Laugungszyklus wären; in beiden Fällen wird das Zinnoxid in einem entsprechenden Ofen zu Metall reduziert.
Reinecken-Ponsgenykopp behandelt die Weißblechabfälle in rotierenden Trommeln mit PbO – Oxidfloh – und Wasserdampf, wobei es ihm gelingt, in Gegenwart von zuvor zugesetzter Natronlauge Natriumstannat SnO3Na2.3H2O zu bilden und Bleimetall abzutrennen.
Natriumstannat kann als Konzentrat oder in kristallisierter Form in den Verkehr gebracht werden, oder in einem weiteren Arbeitsgang kann das Zinn mittels eines Gasstroms von Kohlendioxid und anschließender Reduktion in einem Flammofen ausgefällt werden.
TROCKENMETALLURGISCHE VERFAHREN
Dieser Prozess reduziert sich auf eine Abtrennung des Zinns durch Schmelzen und Oxidation, teilweise zu „Zinnasche“, die in einem Flammofen reduziert oder in geschmolzenen Metallen gelöst wird, oder zur direkten Bildung von Salzen, oder zur Nutzung des Metalls durch einfaches Schmelzen und mechanische Abtrennung der flüssigen Zinntröpfchen.
So mischt Laroque die Weißblechabfälle mit Holzkohle – die kaum Asche enthält – und Natriumchlorid, und Edmunds schmilzt die Weißblechabfälle bei einer Temperatur, die ausreicht, um das Zinn in einer Zentrifuge mit einem speziellen Herd in der Mitte zu verflüssigen, wobei die geschmolzenen Zinntröpfchen durch die Zentrifugalkraft getrennt werden.
Wolterez behandelt die Weißblechabfälle in Retorten mit auf 450-500º C erhitztem Dampf, um das Zinn durch Schmelzen vom Eisen zu trennen; unter diesen Bedingungen oxidiert das Zinn nicht, weil es der reduzierenden Wirkung des Wasserstoffs ausgesetzt ist, der durch die Reduktion des Dampfes auf das erhitzte Eisen entsteht; nur ein schwacher Oxidfilm ist auf der äußeren Schicht des flüssigen Zinns zu erkennen, und das nicht häufig; Es sind auch Verfahren versucht worden, die geschmolzenes Natrium auf die Weißblechzuschnitte einwirken lassen; sie haben den Vorteil, dass sie das Zinn vollständig auflösen und einen Stahlzuschnitt in hervorragendem Zustand zurücklassen, so dass er durch einfaches Schmieden wieder verwendet werden kann, aber das Verfahren ist kompliziert, lästig und gefährlich, wie man aus dem Verlauf des Prozesses schließen kann, den wir in groben Zügen beschreiben: eine Reihe von wasserdichten Ablagerungen und bequem mit Rohren verbunden, all dies wurde in Stahl gebaut und arbeitete als Absaugung; am Kopf wurden die Weißblechzuschnitte zusammen mit reinem Natrium oder Natrium-Zinn-Legierung eingeführt; einmal hermetisch verschlossen, wurde der Apparat in einem Gasofen auf 400-500º C erwärmt; das Vakuum wurde hergestellt und der Inhalt wurde geschüttelt, so dass das Zinn in etwa fünfzehn Minuten aufgelöst wurde: setzt man die Auslaugung in einem kontinuierlichen Zyklus fort, wird eine 50/50-Legierung erreicht; jetzt muss nur noch das Natrium durch Destillation zurückgewonnen werden, um das Zinn zu erhalten.
ELEKTROLYTISCHE VERFAHREN
Am Anfang arbeiteten wir mit sauren Elektrolyten: Schwefelsäure, Natriumsulfat und Chloride; mit dieser Art von Elektrolyten waren die Ausbeuten gering und es wurde bald aufgegeben. Heute wird nur noch der basische Elektrolyt verwendet, aber wir geben einen kleinen Einblick, wie er früher verwendet wurde.
Gutensonn arbeitete mit einem Elektrolyten aus 10%iger Schwefelsäure, der auf 60ºC erhitzt wurde. Er bildete die Anode mit den Weißblechpaketen, die in hölzerne Körbe von 1200 x 300 x 800 mm gelegt wurden, d.h. mit einem Volumen von 0,288 Kubikmetern, während die Bäder von ungefähr einem Kubikmeter Kapazität mit Kiefern- oder Buchenholz von 50 mm Dicke gebaut wurden, bedeckt mit 3,5 mm Dicke von komprimiertem Gummi. Die Kathoden wurden mit verzinnten Kupferblechen von 1200 x 0,50 x 1,5 mm gebildet; in jedem Bad befanden sich acht Anodenkästen und 16 Kathodenkästen im Abstand von 100 mm. Die Arbeitscharakteristik war 240 A, 15 V, was theoretisch 4,15 kg Zinn pro Stunde abscheiden sollte, aber die praktische Ausbeute erreichte kaum 45%, weil der Rest des Stroms für die Auflösung des Eisens und die Freisetzung von Wasserstoff verwendet wurde, so dass ein ziemlich reines Zinn erhalten wurde.
Beim alkalischen Verfahren ist der Elektrolyt 10% NaOH, der Rest bleibt übrig; nun geht das Zinn als Natriumstannat der Formel SnO3Na2 in Lösung, sehr gut löslich, das sich als Metall an der Kathode abscheidet.
Die Ausfällung erfolgt langsamer als die Auflösung, so dass der Elektrolyt allmählich, wenn auch mit abnehmender Geschwindigkeit, mit Zinn angereichert wird.
Ein besonderer Feind der Stromausbeute ist die Begierde der Natriumlauge des Elektrolyten nach dem atmosphärischen Kohlendioxid; wenn NaOH karbonisiert, verliert es an Auflösungsaktivität und elektrischer Leitfähigkeit, was die Verpflichtung auferlegt, den Elektrolyten zu oft zu erneuern, um das gebildete Natriumkarbonat und die in der Anode durch Kaustifizierung gelösten Verunreinigungen zu beseitigen; es ist zweckmäßig, den Elektrolyten häufig umzurühren, damit die Anode nur zinnhaltige Ionen abgibt.
Die Arbeitstemperatur liegt bei ca. 70º C mit einer Anodendichte von 18 A/m2 und 100 A/m2 im Kathodenbereich, so dass der Anodenstromwirkungsgrad 94-95% beträgt, wenn der Elektrolyt 10% freie Alkalien enthält. Wenn die Elektrolyse plötzlich stoppt, verschwinden die zinnhaltigen Ionen und es gibt einen sofortigen Anstieg der Klemmenspannung von ca. 0,7-1,2 V.
Jetzt beginnt aller Wahrscheinlichkeit nach die Entzinnung der Eisen-Zinn-Legierung; die Spannung steigt schnell auf 1,8 V an und es verbleiben nur noch 0,08% Zinn im Blech, d.h. ca. 2,40% der gesamten rückzugewinnenden Menge; der Stromwirkungsgrad beträgt jetzt 88-89%, der auf 82-83% sinkt, wenn die Spannung auf 2,5 V ansteigt, und es verbleiben nur noch 0,02% Zinn, was 0,05-0,06% der hauptsächlich im Clipping enthaltenen Menge entspricht.
Die Abnahme des elektrischen Wirkungsgrads zeigt, dass sich die anodische Arbeit hauptsächlich auf das Eisen konzentriert; es wird passiv und gibt Sauerstoff ab, was den Stromwirkungsgrad verringert.
Die Farbe des anodischen Rückstandes ist weder bestimmend noch indikativ für den Grad der Zinnauslaugung; ist sie bei einem Gehalt von 0,28% Sn bläulich-grau und bei 0,02% Sn rötlich, zeigt sie bereits bei 0,08% rötliche Ausblühungen.
Ist der Elektrolyt dagegen ganz oder teilweise karbonisiert oder wird nicht sehr kräftig gerührt, sinkt der Grad der Entzinnung nur wenig, aber die Klemmenspannung steigt und der Stromwirkungsgrad sinkt.
Der Zinnanteil im Elektrolyten darf nicht höher als 2,34% sein, da sonst die Sättigung den anodischen Angriff behindert und als unangenehme Folge unlösliche Methanolwasserstoffsäure entstehen kann, die nicht rückgewinnbar ist und im anodischen Schlamm verloren geht.
Das alkalische Verfahren ist schneller und billiger als das saure Verfahren und erfordert viel Wachsamkeit. Der Vorteil gegenüber dem Verfahren mit saurem Elektrolyt ist, dass es einen Stahlrückstand produziert, der in Stahlwerken sehr beliebt ist, während der anodische Rückstand des Verfahrens, das mit saurem Elektrolyt arbeitet, nur zur Gewinnung von Eisensulfat verwendet werden kann.
Das saure Verfahren hat dagegen den Vorteil, dass das Zinn als zinnhaltiges Ion in Lösung geht, so dass theoretisch mit der gleichen Menge an Coulomben doppelt so viel Zinnmetall abgetrennt werden sollte.
TROCKENE CHLORAUSWASCHUNG
Das Wort Auslaugen kommt aus dem Lateinischen: „Lixivia, -ae“ feminines Substantiv mit der Bedeutung Lauge. Die Römer benutzten diesen Begriff, um den Saft zu bezeichnen, der aus Trauben destilliert wurde, bevor sie gequetscht wurden, oder aus Oliven, bevor sie gemahlen wurden. Heutzutage versteht man unter Laugung das Waschen einer pulverisierten Substanz, um die löslichen Bestandteile zu extrahieren.
Von Higgins vorgeschlagen und von Parmelee, Lambotte Goldsmitd und Weber perfektioniert, hat es die anderen Extraktionsmethoden industriell überflügelt, weil das trockene Chlor das Zinn leicht auflöst und es erlaubt, es in Form von Zinnchlorid abzutrennen, ohne den Trägerstahl anzugreifen; Deutschland gewinnt durch dieses Verfahren mehr als 85% der Produktion an Verschnitt zurück.
Winteler erhält Zinnchlorid, indem er trockenes Chlor bei einer kontrollierten Temperatur von 40-50º auf das Weißblech in Abschnitten einwirken lässt, da in diesem Temperaturbereich das Chlor das Eisen nicht angreift; dazu ist es notwendig, dass die Temperatur im Auslaugungsreaktor 100º C übersteigt; wenn sich durch ein Versehen Eisenchlorid bildet, wird man metallurgisch sagen, dass das „Zinn verbrannt“ wurde; es muss berücksichtigt werden, dass die Reaktion:
2Cl2 + Sn = Cl4Sn
Sie setzt 127,25 Kcal/mol frei. von gebildetem Zinnchlorid, das aufgrund des auftretenden Temperaturanstiegs die Laugungsleistung zunichte machen kann. Der kritische Punkt ist auf den Eintritt von Chlor in den Reaktor zentriert; aufgrund der hohen spezifischen Dichte der vorhandenen reaktionsfreudigen Chlormole kann sich eine leichte Schicht aus wasserfreiem, kristallinem Eisen(III)-chlorid bilden, die aufgrund ihrer Hygroskopizität die Feuchtigkeit der Einhausung aufnimmt und von diesem Moment an kann sich die Auflösung von Eisen in Form von Eisentrichlorid mit enormer Geschwindigkeit im gesamten Blatt manifestieren; dieses Problem wurde von Weber J. gelöst. durch intensives Kühlen des Reaktors, wodurch der Prozess verbessert und heißes Wasser zum Waschen der zurückgewonnenen Dose gewonnen wird.
Das Verfahren zur Rückgewinnung von Zinn aus Weißblech basiert auf der Eigenschaft von trockenem Chlor, Zinn leicht anzugreifen und das tragende Eisen zu schonen, solange keine Spur von Feuchtigkeit im Reaktor vorhanden ist; wirtschaftlich kann es nicht rentabel sein, wenn nicht genügend billiges trockenes Chlor zur Verfügung steht, und mit diesem Verfahren werden in einem einzigen Arbeitsgang die beiden Bestandteile des Weißblechs gleichzeitig gewonnen. Einerseits Zinnchlorid von großem Wert für die Anwendung beim Färben von Textilfasern – Seide usw. – und andererseits Stahl oder Weicheisen, die mit weniger als 0,1 % Sn perfekt entzinnt sind. Im Vergleich zu den anderen Rückgewinnungsmethoden hat das trockene Chlorentzinnungsverfahren nur Vorteile:
– Das erste und das zweite vorgestellte Verfahren sind veraltet, von unsicheren Ergebnissen, sie erfordern teure Anlagen und die Kosten für das zurückgewonnene Zinn werden nur unter besonderen Bedingungen eines Landes kompensiert.
– Bei der Elektrolyse mit saurem Elektrolyt wird zu viel Energie verbraucht, da 50-35 % der gesamten zugeführten Menge an Faradays bei der Arbeit der Eisenauflösung und der Wasserstofferzeugung verbraucht werden; die Anlagen sind teuer, sehr anfällig für ständige und schwerwiegende Ausfälle wie alle, die mit sauren Flüssigkeiten arbeiten, so dass die wirtschaftliche Ausbeute nicht brillant ist und das Zinn zu teuer ist, um auf den Markt gebracht zu werden.
– Die Elektrolyse mit basischem Elektrolyt hat einige technische Vorteile gegenüber der mit saurem Elektrolyt; der hohe Energieverbrauch – 3.000 kWh/Tm – des zurückgewonnenen Zinns trägt die Behandlung jedoch nicht zu dem Preis, zu dem die kWh in Rechnung gestellt werden, und da sie eine zu komplexe Anlage erfordert, wäre es nach heutigem Stand der Dinge ein Wunder, dass sie wirtschaftlich rentabel wäre.
– Die Entzinnung durch Einwirkung von trockenem Chlor auf die Weißblechabfälle löst das Problem elegant und einfach; sie erfordert wenig installierte Kraft, wenig Personal, wenig monetäre Immobilisierung und das Nebenprodukt kann nach einer einfachen Wäsche problemlos an die Stahlwerke verkauft werden.
Flüssiges Chlor ist ohne große Schwierigkeiten zu beschaffen – es wird von Solvay y Cia. hergestellt – das schwierigste Problem ist es, eine deckungsgleiche und gut funktionierende Linie für die Sammlung von Weißblechabfällen zu errichten.
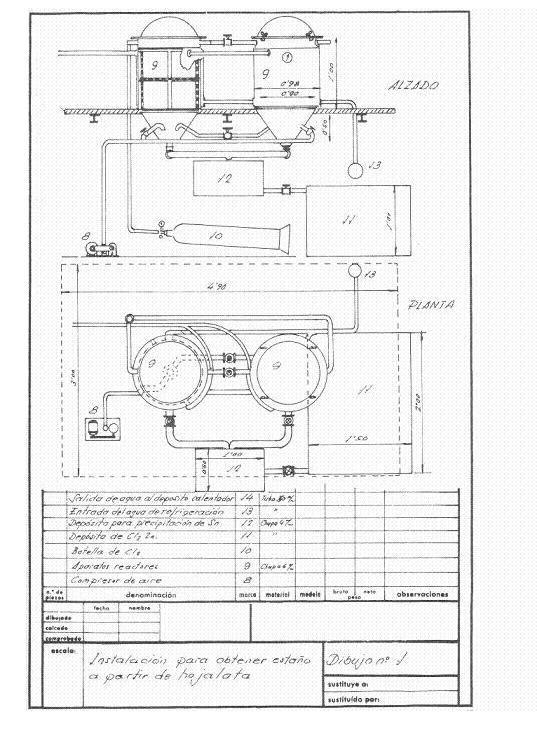
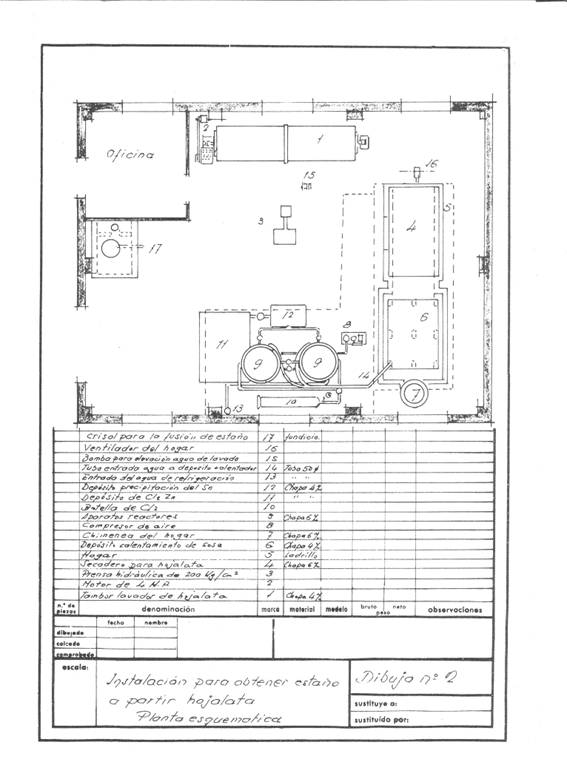
Die Abbildungen 1 und 2 geben eine Vorstellung von der projektierten Anlage; es wurde von einer Verwertungsfrequenz von 4 Tonnen Schnittgut pro Tag ausgegangen, die in einer Schicht arbeitet, und es wurde angenommen, dass sie in Kampagnen arbeitet.
Bild Nr. 1: Beispiel 1 der Entkonservierungsanlage
Bild Nr. 2: Beispiel für eine 2. Entzinnungsanlage
Als die Verschnitte im Werk ankamen, wurden sie zunächst mit ca. 2 Kubikmetern einer Lösung von 11-12 Be Dichte von Natriumkarbonat gewaschen, die 2160 kg wiegt und 1250 kg kristallines Soda – Reinheit 98% – enthält, eine Behandlung, deren Aufgabe es ist, die Fettabfälle, die die Verschnitte enthalten können, zu verseifen und Druckfarben und Lacke zu entfernen.
Die Verseifung ist eine chemische Reaktion zwischen einer Fettsäure (oder einem verseifbaren Lipid, das Fettsäurereste trägt) und einer Base oder Lauge, bei der das erhaltene Hauptprodukt das Salz der Säure und der Base ist. Diese Verbindungen haben die Besonderheit, dass sie amphipathisch sind, d.h. sie haben einen polaren und einen apolaren (oder unpolaren) Teil, so dass sie mit Substanzen unterschiedlicher Eigenschaften wechselwirken können. Seifen sind z. B. Salze von Fettsäuren und Alkalimetallen, die durch dieses Verfahren gewonnen werden. Die Verseifungsmethode im industriellen Aspekt besteht darin, das Fett in großen Kesseln zu kochen, langsam Natronlauge (NaOH) hinzuzufügen und das Gemisch ständig zu rühren, bis es anfängt, pastös zu werden.
Dieser Vorgang wird in einer Drehtrommel mit einem Fassungsvermögen von ca. 3,14 Kubikmetern und einer Waschfläche von ca. 14,13 m2 durchgeführt, die aus 4 mm dickem Eisenblech gebaut und von einem 4-PS-Motor angetrieben wird.
Nach Beendigung des Waschvorgangs wurde die Lauge zusammen mit den Seifen in einen Tank mit einem Fassungsvermögen von ca. 3 m3 umgefüllt, der sich über dem Trocknungsofen des Weißblechs befand, um sie warm zu halten und sie bis zu ihrer Erschöpfung für neue Behandlungen wieder verwenden zu können.
Die fett-, lack- und farbfreien Verschnitte werden mit heißem Wasser gespült, das großzügig aus der Kühlung der Entkonservierungsreaktoren gewonnen wird.
Die sauberen Verschnitte werden in prismatischen Paketen von 400 x 170 x 200 mm, die mit einem Gewicht von ca. 50 kg leicht handhabbar sind, in einer hydraulischen Presse mit ca. 200 kg/cm2 gepresst.
Diese Pakete werden unter Atmosphärendruck bei ca. 200º C zwei Stunden lang getrocknet, wobei durchschnittlich 150 kg Kohle bei 7000 Kcal/kg verbraucht werden. Die Trocknungskammer war eine Art Trockner aus Regalen – ohne großes Gebilde – gebaut aus „Glück“, wo ein mittleres Gebläse die heiße Luft einblies, um das Wasser durch den Schornstein zu ziehen: Alles war bequem isoliert mit einer Schicht aus Magnesia 85%, 60 mm dick und 280 kg schwer, und bevor man es an die Atmosphäre schickte, wurde es dazu gebracht, überschüssige Kalorien abzugeben, um die Prozesslösungen zu erhitzen, der Schornstein von 500 mm Durchmesser ragte kaum aus dem Dach heraus.
Die Entzinnungsreaktoren waren zwei in Reihe, und trockene Luft konnte nach Belieben in sie eingeblasen werden, um das restliche Chlor aus dem fertigen Reaktor in den anderen zu leiten, so dass, während der eine entzinnt wurde, das Zinnchlorid und der zurückgewonnene Stahl aus dem anderen extrahiert wurden.
Zu Beginn des Tages wurden die beiden Reaktoren mit den gepressten und getrockneten Zinnpaketen beladen. In der ersten wurde trockenes Chlor bei 2 atm belassen. Wenn der Druck reduziert und das Kühlwasser fließen gelassen wird, dehnt sich das Chlorgas an der freien Oberfläche des Reaktors aus und wirkt auf das Zinn im Weißblech ein; dieses nimmt kontinuierlich Chlor auf, solange nicht umgesetztes Zinn vorhanden ist, und wenn alles Zinn in Zinnchlorid umgewandelt wurde, bleibt der Druck konstant und der Angriff wird beendet. Nach einem geeigneten Zeitintervall wird der Apparat mit trockener Luft angeblasen, um den Chlorüberschuss in den konservierten Reaktor zu befördern, der, sobald er geschlossen ist, zu arbeiten beginnt, während aus dem fertigen Reaktor das gesamte gebildete Zinnchlorid durch den Boden ausgeblasen wird, und wenn es nicht mehr tropft, wird die Masse des entzinnten Stahls herausgenommen, gut mit heißer Natriumkarbonatlösung gewaschen, dann mit dem heißen Wasser des Reaktors gespült und ein sehr vorteilhafter Weichstahlrückstand für Stahlwerke erhalten. Auf diese Art und Weise haben wir 251 kg Zinnchlorid zurückgewonnen und 230-240 kg Chlor verbraucht.
Diese Zahl an zurückgewonnenem Zinnchlorid entspricht einer Rückgewinnung von 115 kg metallischem Zinn, d. h. einer Rückgewinnungsausbeute von 96 %, so dass das Resteisen nur noch 0,10-0,13 % Zinn enthält und somit problemlos an die Stahlwerke geschickt werden kann.
Da die Auflösungsreaktion sehr exotherm ist, muss die Abkühlung sorgfältig überwacht werden, um eine gute Ausbeute zu erzielen: Andernfalls besteht eine gewisse Gefahr, dass die Dose verbrennt.
Flüssiges Chlor ist im Handel in Stahlflaschen erhältlich, ähnlich denen von Sauerstoff, Acetylen, Kohlendioxid usw.; sie enthalten 50 kg Nettogewicht bei 6 atm und jedes Kilogramm flüssiges Chlor liefert 334 Liter trockenes Chlorgas.
Während der Arbeitszeit verwendeten wir 5 Flaschen pro Tag, um die 4 Tm Stecklinge auszulaugen; wir ließen das flüssige Chlor von 6 auf 2 atm expandieren, wofür wir einen handelsüblichen Druckregler verwendeten.
Da Zinnmetall zu dieser Zeit knapp war, entwickelten wir auch ein Reduktionsverfahren für Zinnchlorid. Dazu dachten wir daran, eine elektrolytische Reduktion ohne Stromaufwand und mit einer minimalen Installation zu starten; es scheint ein Widerspruch zu sein, aber nach den entsprechenden Tests war die Idee nicht unvernünftig, wir mussten nur eine Nutzung der vorhandenen Spannungsdifferenz zwischen Zink und Zinn entwickeln. Bei der Untersuchung des Problems gelangten wir zu einer Gewissheit: Wir sahen, dass ein Zinkblech, das in eine mit Salzsäure leicht angesäuerte Lösung von Zinnchlorid (pH=5-6) eingeführt wurde, die folgenden Arbeiten durchführte:
Cl4Sn + 2 Zn = 2 Cl2Zn + Sn
Cl4Sn + Sn = 2 Cl2Zn
2 Cl2Sn + 2 Zn = 2 Cl2Zn + 2 Sn
Dies führt zu der Überlegung, dass das gesamte Zink aufgelöst wird und das gesamte Zinn in einer schwammigen Form mit metallischem Charakter ausfällt, die gesammelt, gewaschen und umgeschmolzen wird, um einen Barren zu erhalten.
Gemäß den schriftlichen Reaktionen sind 65 kg Zink erforderlich, um das gesamte Zinn aus dem gebildeten Zinnchlorid zu gewinnen. Wir verwendeten 1 mm dicke Zinkbleche, die ein Gewicht von 6,9 kg pro Quadratmeter haben, und benötigten daher täglich etwa 9,5 Quadratmeter Zinkblech.
Wir haben dafür eine „Fortune“-Installation gemacht. Wir bauten einen Container von 1000 x 600 x 500 mm und platzierten darin Zinkbleche, die an Holzrahmen aufgehängt waren. Nach Beendigung der Fällung nahmen wir die Zinnschwämme mit Holzpaddeln, entfernten sie und wuschen sie gut mit heißem Wasser und schmolzen sie in einem Eisentiegel leicht bei 231,5º C mit einem Kohleverbrauch von 6-7 % eines 7000 Kcal/kg Pellets.
Nach dem Schmelzen wurde die Flüssigkeit mit Hilfe von grünen Holzzweigen entfernt, um zu desoxidieren; die Schlacke wurde entfernt und die gereinigte Flüssigkeit wurde in Barrenformen eingeleitet, wodurch ein Metall mit einer Reinheit von 99,3 bis 99,7 % erhalten wurde, das zum Schweißen und zur Herstellung von Bronzen und anderen Legierungen geeignet ist.
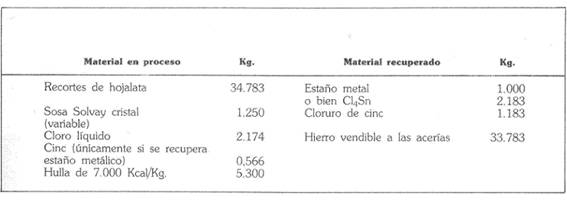
Die folgende Tabelle ist eine kurze Materialbilanz des Betriebs, erstellt für eine Produktion von einer Tonne Metall, was 2.183 kg Zinnchlorid entspricht“.














Die verschiedenen Verfahren zur Rückgewinnung von Zinn sind sehr interessant. Ich arbeite in der metallurgischen Industrie. Deshalb möchte ich mich da ein bisschen besser auskennen.