1. INTRODUZIONE: LA NATURA DELLA CORROSIONE NEGLI IMBALLAGGI METALLICI
La corrosione è definita tecnicamente come la distruzione lenta di un metallo a causa dell’azione di un agente esterno, che dà luogo a un attacco chimico o fisico-chimico. Sebbene i metalli siano solitamente elementi stabili, l’intervento di agenti esterni rompe questo equilibrio. Nel contesto degli imballaggi metallici, fondamentalmente di banda stagnata, questo fenomeno è critico per l’integrità del prodotto e la sicurezza alimentare.
Tutti i metalli sono a contatto con l’aria, composta per il 79% da azoto e per il 21% da ossigeno. Dato che l’azoto è un gas inerte, l’azione aggressiva dell’atmosfera sui metalli ricade quasi esclusivamente sull’ossigeno. Tuttavia, affinché il processo corrosivo si inneschi e progredisca, l’ossigeno richiede dei collaboratori:
- Il calore: Che, insieme all’ossigeno atmosferico, produce l’ossidazione superficiale.
- L’umidità: Che, in combinazione con l’ossigeno, produce la corrosione vera e propria.
2. FONDAMENTI ELETTROCHIMICI E LA COPPIA GALVANICA
Per comprendere la corrosione negli imballaggi, è imperativo capire il comportamento elettrochimico dei metalli. I metalli si classificano in base al loro potenziale elettrico:
- Anodici: Metalli con potenziale negativo che tendono a cedere elettroni e ossidarsi con facilità.
- Catodici: Metalli con potenziale positivo (come i metalli nobili) che attraggono ioni positivi e sono resistenti alla corrosione.
Quando due metalli diversi si collegano o entrano in contatto in presenza di un elettrolita, si forma una Coppia Galvanica. In questa situazione, il metallo con il potenziale minore (il più anodico) è quello che si ossida.
2.1. Il Caso Specifico della Banda Stagnata (Ferro e Stagno)
La banda stagnata presenta un comportamento duale affascinante a seconda che l’esposizione sia interna (senza ossigeno) o esterna (con ossigeno).
A) All’interno dell’imballaggio (Assenza di ossigeno): Lo stagno (Sn) agisce come anodo rispetto al ferro (Fe).
- Reazione: Sn⁰ ⇔ Sn⁺² + 2e⁻ (E₀ = -0,13 V).
- Ferro: Fe⁰ ⇔ Fe⁺² + 2e⁻ (E₀ = -0,44 V).
- Lo stagno si ossida, proteggendo il ferro. Questo fenomeno implica una destagnatura, ma mantiene l’integrità strutturale dell’acciaio di base.
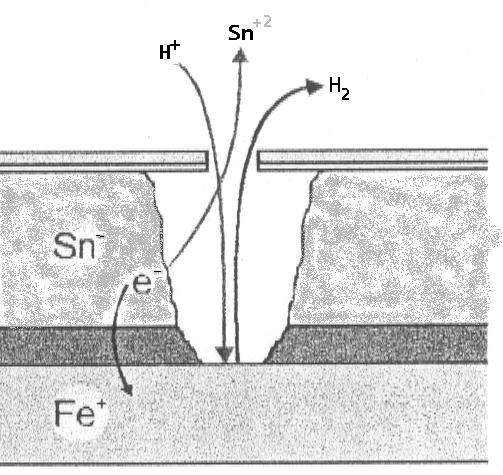
B) All’esterno dell’imballaggio (Presenza di ossigeno): Si produce un’inversione di polarità. Il ferro si comporta come anodo e si ossida rispetto allo stagno, che agisce come catodo.
- Il ferro, essendo più elettronegativo in questo ambiente, subisce la corrosione.
- Questo dà luogo alla formazione di ossidi e idrossidi di ferro (la nota “ruggine”), il cui colore varia dal giallo all’arancione a seconda dell’idratazione.
Le reazioni chimiche dell’ossidazione del ferro sono: Fe → Fe²⁺ + 2e⁻ (da metallo a ione ferroso) Fe²⁺ → Fe³⁺ + e⁻ (da ione ferroso a ferrico)
In presenza di umidità ambientale, il prodotto finale è l’ossido ferrico idratato di colore arancione-rossastro: 2 Fe₂O₃ + 6H₂O → 4 Fe(OH)₃
3. CLASSIFICAZIONE DEI TIPI DI CORROSIONE
La corrosione può essere classificata in tre grandi categorie a seconda dell’agente esterno che la innesca.
3.1. Corrosione Elettrochimica È la più comune nei metalli esposti ad atmosfere umide o immersi in acqua. Si basa sulle serie galvaniche menzionate in precedenza. Un esempio classico è il comportamento del ferro rispetto allo zinco o allo stagno:
- Rispetto allo Zinco (Zn= -0,763 V), il ferro (Fe= -0,440 V) è protetto perché lo zinco è più anodico.
- Rispetto allo Stagno (Sn= -0,135 V), il ferro viene attaccato.
La presenza di sali, come il cloruro di sodio (NaCl), accelera questo processo secondo la reazione: 2 ClNa + 2 H₂O ↔ 2 HCl + 2 NaOH Il sale reagisce ma non si distrugge, contribuendo a continuare il processo di corrosione finché ci sono metallo e umidità.
3.2. Corrosione Chimica Prodotta dall’attacco diretto di acidi e alcali.
- Acidi: Il ferro viene attaccato da acidi non ossidanti. La presenza di zolfo è particolarmente pericolosa, formando solfuro di ferro e agendo come catalizzatore, il che rende rischioso l’uso di composti solforati negli imballaggi.
- Alcali: Attaccano metalli come l’alluminio e lo stagno. Lo stagno forma stanniti di sodio solubili, il che dissolve lo strato protettivo fino alla distruzione totale del rivestimento.
3.3. Corrosione Microbiologica È una delle forme meno conosciute ma altamente distruttiva. Si produce a causa dell’azione di:
- Batteri anaerobici: Generano metaboliti corrosivi.
- Batteri aerobici: Producono acidi minerali corrosivi.
- Funghi: Originano acidi organici metabolici.
Il metabolismo di questi microrganismi genera gas (CO₂, H₂, N₂) e sostanze come ammoniaca, acqua ossigenata e solfuri, creando un microambiente altamente aggressivo per l’imballaggio.
4. PROPAGAZIONE E MORFOLOGIA: CORROSIONE LOCALIZZATA
Sebbene esista la corrosione uniforme (che interessa tutta la superficie), questa è rara negli imballaggi rivestiti. La forma più comune nella banda stagnata è la corrosione localizzata, che attacca zone specifiche lasciandone altre intatte, generalmente a causa di difetti o porosità nel rivestimento (vernice o stagno).
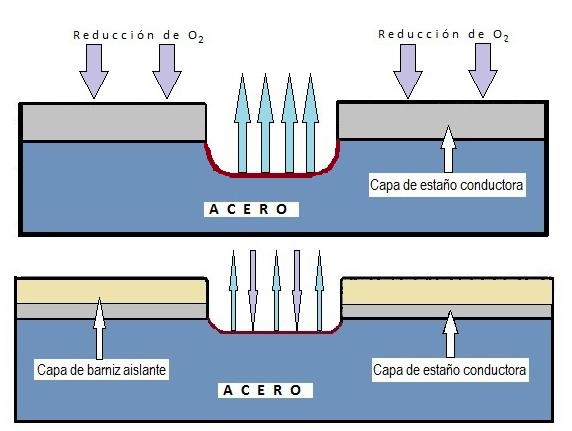
Esistono vari tipi di corrosione localizzata di particolare rilevanza:
4.1. Corrosione Intergranulare Interessa l’unione dei grani nella struttura cristallina del metallo, indebolendo la sua resistenza meccanica e provocando rotture irregolari. Non è la più comune negli imballaggi.
4.2. Corrosione per Fessure o Anfratti (Crevice Corrosion) Si verifica in interstizi o zone nascoste dove ristagnano piccoli volumi di soluzioni corrosive (sali o acidi). È tipica nelle chiusure degli imballaggi o sotto gli anelli di facile apertura.
4.3. Corrosione Filiforme Questa è una variazione superficiale che si verifica sotto rivestimenti non conduttivi (vernici). Si caratterizza per la formazione di filamenti stretti (da 0,05 a 3 mm di larghezza) che serpeggiano sotto la vernice.
- Meccanismo: Funziona per aerazione differenziale. La “testa” del filamento è la zona anodica (dove inizia la corrosione e c’è acidificazione) e la “coda” è la zona più aerata.
- Fattori: Richiede un’umidità relativa superiore al 60% e la presenza di sali (cloruri) come iniziatori.
- Prevenzione: La qualità o la quantità di vernice non ne evita la formazione; la chiave è mantenere l’umidità bassa ed evitare residui salini.

4.4. Corrosione per Pitting (Pitting) È la forma più comune e pericolosa di corrosione localizzata. Si origina in imperfezioni o zone mal aerate (sotto depositi). La sua pericolosità risiede nel fatto che perfora il metallo in profondità, a volte essendo quasi invisibile a occhio nudo dall’esterno. Le pitting possono assumere diverse morfologie (strette e profonde, ellittiche, a gallerie, ecc.).
4.5. Corrosione da Stress (SCC) Implica una rottura fragile del metallo a causa della combinazione di tre fattori simultanei:
- Tensione di trazione (stress).
- Un mezzo corrosivo specifico.
- Un metallo suscettibile.
Il processo ha due fasi: la formazione di una cricca iniziale e la sua propagazione fino alla frattura del materiale. È comune osservare questo in zone di imbutitura profonda o nei rivetti dei coperchi di facile apertura.
4.6. Danno da Idrogeno Causato dalla diffusione di idrogeno nel metallo, spesso accelerata da ioni solforati provenienti dalla decomposizione di proteine (tioproteine) nell’alimento. Reazione base: 2 H⁺ + 2 e⁻ → H₂↑
5. FATTORI DEL PROCESSO DI FABBRICAZIONE E IMBALLAGGIO
La corrosione esterna non è solo un problema di materiale, ma di processo. Molteplici fasi influenzano la suscettibilità dell’imballaggio:
5.1. Danni Meccanici e Riempimento
- Linee di alimentazione: Gli sfregamenti e gli urti danneggiano la vernice esterna, esponendo l’acciaio di base.
- Chiusura: È critico la regolazione delle aggraffatrici. Rullini mal lubrificati o mandrini non regolati possono danneggiare il rivestimento nella zona di chiusura.
- Riempimento: Resti di prodotto sull’imballaggio contaminano l’acqua di sterilizzazione, aumentandone l’aggressività.
5.2. Sterilizzazione e Raffreddamento Durante il trattamento termico in autoclave:
- Si consiglia di utilizzare separatori tra gli strati per evitare sfregamenti a caldo.
- L’aria utilizzata per la contropressione apporta ossigeno corrosivo.
- L’introduzione diretta di vapore può trascinare condense alcaline dalle caldaie che attaccano la vernice.
- Asciugatura: È fondamentale che la temperatura finale dell’imballaggio permetta l'”autoasciugatura”. L’umidità rimanente nella vaschetta del coperchio o sotto l’anello è un terreno fertile per pile galvaniche.
6. QUALITÀ DELL’ACQUA: UN FATTORE DETERMINANTE
L’acqua di processo (sterilizzazione e raffreddamento) può essere corrosiva o incrostante. Parametri chiave da controllare:
- pH: Mezzi acidi o molto alcalini attaccano metallo e vernice. Intervallo ideale: 6,5 – 8,5.
- Conducibilità: Valori alti (< 2000 µS/cm raccomandati) favoriscono il flusso di corrente nelle pile galvaniche.
- Cloruri e Solfati: Devono essere mantenuti al di sotto di 25 mg/l.
- Residuo Secco (TDS): Inferiore a 500 mg/l.
6.1. Indici di Valutazione dell’Acqua Per prevedere il comportamento dell’acqua si utilizzano indici specifici:
A) Indice di Langelier (LSI): Valuta l’equilibrio del carbonato di calcio. Formula: LSI = pH – pHs
- Un LSI negativo (< -0,4) indica acqua corrosiva.
- Un LSI positivo (> 0,2) indica acqua incrostante (precipitante).
B) Indice di Ryznar (RSI): Formula: RSI = 2(pHs) – pH
- Valori >> 7 o 8 indicano alta corrosività.
- Valori << 6 indicano tendenza alle incrostazioni.
Le incrostazioni (macchie bianche di carbonati) non sono solo un problema estetico; agiscono come zone di ritenzione dell’umidità, favorendo la corrosione successiva.
6.2. Trattamenti di Passivazione Per mitigare l’aggressività dell’acqua, si aggiungono inibitori catodici (passivanti) a base di zinco e acido fosforico. Questi creano una fosfatazione superficiale sull’acciaio che lo protegge. È vitale controllare la dose, poiché un eccesso aumenta la conducibilità e, paradossalmente, l’aggressività dell’acqua.
7. STOCCAGGIO E TRASPORTO: CONTROLLO AMBIENTALE
Una volta fabbricato e lavorato, l’imballaggio è ancora a rischio. La corrosione esterna durante lo stoccaggio e il trasporto è solitamente dovuta alla condensa e alla presenza di sali igroscopici.
7.1. Condizioni di Magazzino
- Umidità Relativa (UR): Deve essere mantenuta bassa (al di sotto del 60% per evitare la corrosione filiforme).
- Temperatura: Evitare sbalzi bruschi che portino al punto di rugiada e alla condensa.
- Salinità: I depositi salini attraggono umidità dall’ambiente (igroscopicità), avviando la corrosione.
- Materiali di imballaggio: Il cartone e i separatori non sono inerti; devono essere analizzati per assicurarsi che non contengano sali aggressivi. L’uso di plastica continua può essere controproducente se trattiene l’umidità interna.


7.2. Il Fenomeno della Condensa (Punto di Rugiada) Il rischio di condensa dipende dal rapporto tra temperatura e umidità relativa. Se la temperatura scende improvvisamente, l’eccesso di vapore si condensa in acqua liquida sugli imballaggi freddi.
Esempi critici di calo di temperatura consentito prima della condensa (per aria iniziale a 35ºC):
- A 20% UR: La temperatura deve scendere di 28ºC (fino a 7ºC) per condensare (Rischio basso).
- A 50% UR: Basta che scenda di 12ºC (fino a 23ºC).
- A 75% UR: Con solo 5ºC in meno (fino a 30ºC) si produce condensa (Rischio molto alto).
Questo è critico nel trasporto marittimo, dove i container subiscono grandi variazioni termiche.
7.3. Protezione contro i Raggi UV La radiazione ultravioletta (solare o di tubi fluorescenti negli insetticidi) degrada le vernici e le litografie, indebolendo la barriera protettiva esterna.
8. METODI DI PROTEZIONE E CONCLUSIONE
La lotta contro la corrosione si basa sulla prevenzione. Le strategie fondamentali includono:
- Mantenere l’integrità della vernice: Una vernice rotta concentra l’attacco anodico.
- Eliminare i residui igroscopici: Pulizia accurata degli imballaggi dopo la chiusura.
- Asciugatura assoluta: Evitare l’acqua nelle fessure (chiusure, anelli).
- Controllo ambientale: Magazzini asciutti, ventilati e con controllo della temperatura per evitare il punto di rugiada.
- Uso di inibitori: Trattamento chimico dell’acqua di processo (passivazione).
In conclusione, la corrosione negli imballaggi metallici è un fenomeno multifattoriale che coinvolge chimica, metallurgia e fisica atmosferica, il cui controllo dipende dalla gestione integrale dell’intero ciclo di vita dell’imballaggio.













