RÉSUMÉ
Description de divers procédés industriels pour la récupération de l’étain contenu dans les chutes de fer blanc mises au rebut par l’industrie métallurgique. On peut en déduire que le plus intéressant est celui qui obtient cet étain par un procédé à sec en le lixiviant avec du chlore.
INTRODUCTION
L’étain est le composant le plus spécifique du fer blanc, ce qui lui confère sa principale caractéristique : sa résistance à la corrosion sous l’action d’éléments extérieurs. C’est un métal de prix élevé sur le marché, car son obtention à partir du minerai, en plus d’être coûteuse, est très contrôlée par les grandes multinationales qui cherchent à maintenir le prix élevé et la rareté de l’offre face à une demande importante. C’est pourquoi, à certaines périodes et dans certaines zones géographiques, il est souvent intéressant d’envisager la récupération de ce métal à partir des chutes de fer blanc provenant des usines d’emballage. C’est pourquoi nous considérons qu’il est intéressant de reproduire partiellement un article de Pedro López Gómez publié sous le titre « LA RÉCUPÉRATION DE L’ANALYSE DE LA PÂTE DU PITCHER » dans la revue « Técnica Industrial ».
« La teneur en étain du fer blanc est variable, allant de 2% en tôle épaisse à 4,5% en tôle fine. En règle générale, les boutures qui ne contiennent pas au moins 2 % d’étain ne peuvent pas bénéficier d’un avantage économique.
Le support en acier Matin – le cœur du fer blanc – doit être extrêmement désétamée afin de pouvoir être réutilisé comme ferraille. La présence d’étain, même en petites quantités, a une influence considérable sur la ductilité de l’acier et une teneur de 0,3% de Sn suffit à le rendre cassant et impropre à la récupération.
Comme nous le savons, le fer blanc est formé d’une couche externe d’étain presque pur, facilement séparable ; en dessous, il y a une autre couche cristalline formée par un véritable alliage étain-fer qui est plus difficile à séparer car elle est fortement adhérente à la feuille de support et difficile à attaquer.
LES TRAVAUX PRÉLIMINAIRES
Avant d’appliquer une méthode de désétamage, il est nécessaire de nettoyer soigneusement les chutes de fer blanc et d’enlever autant de graisse, d’encres, de vernis et de résidus organiques que possible.
À cette fin, des emballages perforés sont préparés et soumis à une sorte de pré-fusion à basse température afin d’éliminer le plus d’étain possible. Avant cette opération, le vernis recouvrant les boutures doit être enlevé. À cette fin, le vernis est facilement dissous dans une lessive Solvay ou de soude caustique alcaline à 10% ; si des résidus d’émail sont observés, les paquets de fer blanc passent dans une calandre à rouleaux disposée de telle sorte que l’un des cylindres travaille à une vitesse plus élevée que l’autre, ce qui provoque une ondulation du paquet et le décollement de l’émail.
Il existe sur le marché des équipements tels que le « Goldschmidt TH », qui presse et perfore les chutes avec des cylindres à pointes, et saponifie les graisses et les vernis avec un traitement à la lessive de sodium à 3% pendant quinze à trente minutes dans un autoclave à 110-115º C, puis les lave à l’eau chaude pour éliminer les savons et les résidus de lessive, puis les chauffe pendant une demi-heure à 500º C pour récupérer la couche externe d’étain, détruisant ainsi la matière organique – les gommes de scellement – et presse à nouveau.
Dans cette opération, il a pris soin de ne pas former de coqs de la matière organique, ce qui empêcherait plus tard la pénétration des agents de désétamage.
Les procédés de désétamage connus peuvent être classés en quatre groupes principaux :
a) – Processus chimiques humides.
b) – Procédés métallurgiques à sec
c) – Procédés électrolytiques au moyen d’une solution dans des acides ou des alcalis.
d) – Procédés utilisant du chlore sec
Nous allons examiner chacun d’entre eux ci-dessous.
LES PROCÉDÉS CHIMIQUES HUMIDES
Pendant longtemps, la récupération de l’étain à partir du fer-blanc a été expérimentée en utilisant des procédés chimiques de solutions acides, alcalines ou salines, en renonçant à poursuivre son utilisation pour avoir de faibles rendements en toute occasion.
Kecth et Hette se sont engagés dans cette voie en vue d’une électrolyse ultérieure ; mais Goldsch-Midt a montré que lorsque l’étain est dissous par des acides, le fer, qui est difficile et coûteux à séparer, est dissous en même temps. Les alcalis seuls ou avec l’ajout d’agents oxydants n’attaquent pas le fer, mais ils n’éliminent pas non plus complètement l’étain, de sorte que la tôle d’acier ne peut pas non plus être utilisée industriellement.
Schulze traite le fer-blanc avec une solution de chlorure stanneux ; il dissout l’étain métallique pour le réduire en sel stanneux :
Cl4Sn + Sn = 2 Cl2Sn
Puis passe la vapeur d’eau, qui précipite l’oxychlorure stanneux et régénère le chlorure stanneux, qui retourne dans le cycle :
6 Cl2Sn + 2 H2O + O2 = 4 ClSnOH + 2 Cl4Sn
Le ClSnOH séparé est filtré et transformé en oxyde stannique SnO2 par oxydation rouge en présence d’air avec libération de chlore, qui est récupéré :
4 SnClOH + 3 O2 = 4 SnO2 + C l2 + 2 H2O
Le chlorure ferrique a également été utilisé à la place du chlorure stannique comme solvant, car si le Cl3Fe est présent en excès, l’étain est oxydé et le fer est réduit :
4 Cl3Fe + Sn = Cl4Sn + 4 Cl2Fe
Lorsque la quasi-totalité du chlorure ferrique a oxydé l’étain en chlorure stanneux, il est réduit en chlorure stanneux avec l’excès d’étain présent.
Cl4Sn + Sn = 2 Cl2Sn
Avec de la vapeur d’eau, on transforme celle-ci en chlorure stanneux basique et, par une calcination ultérieure, on obtient de l’oxyde stanneux et on récupère le chlore nécessaire à la régénération du chlorure ferrique par oxydation de Cl2Fe :
2 Cl2Fe + Cl2 = 2 Cl3Fe
Ce qui revient au cycle de lixiviation ; dans les deux cas, l’oxyde stannique est réduit en métal dans un four approprié.
Reinecken-Ponsgenykopp traite les déchets de fer blanc dans des tambours rotatifs avec du PbO – une puce d’oxyde – et de la vapeur d’eau, ce qui lui permet – en présence de lessive de soude préalablement ajoutée – de former du stannate de sodium SnO3Na2.3H2O et de séparer le plomb métallique.
Le stannate de sodium peut être mis sur le marché sous forme concentrée ou cristallisée, ou dans une opération ultérieure, l’étain peut être précipité au moyen d’un flux gazeux de dioxyde de carbone et d’une réduction ultérieure dans un four à réverbération.
LES PROCÉDÉS MÉTALLURGIQUES À SEC
Ce processus se réduit à une séparation de l’étain par fusion et oxydation, en partie à des « cendres d’étain », qui sont réduites dans un four à réverbération ou dissoutes dans des métaux fondus, ou pour former directement des sels, ou pour utiliser le métal par simple fusion et séparation mécanique des gouttelettes d’étain liquides.
Par exemple, Laroque mélange les déchets de fer blanc avec du charbon de bois – qui ne contient pratiquement pas de cendres – et du chlorure de sodium, et Edmunds fait fondre les déchets de fer blanc à une température suffisante pour liquéfier l’étain dans une centrifugeuse équipée d’un foyer spécial en son centre, où les gouttelettes d’étain fondu sont séparées par la force centrifuge.
Wolterez traite les déchets de fer blanc dans des cornues avec de la vapeur chauffée à 450-500º C, pour séparer l’étain du fer par fusion ; dans ces conditions, l’étain ne s’oxyde pas car il est exposé à l’action réductrice de l’hydrogène produit par la réduction de la vapeur sur le fer chauffé ; seule une légère pellicule d’oxyde peut être détectée, et pas fréquemment, sur la couche extérieure de l’étain liquide ; On a également essayé des procédés qui font agir le sodium fondu sur les découpes de fer blanc ; ils ont l’avantage de dissoudre complètement l’étain, laissant une découpe d’acier dans d’excellentes conditions pour qu’avec un simple forgeage elle puisse être réutilisée, mais le procédé est compliqué, ennuyeux et dangereux, comme on peut le déduire de l’évolution du processus que nous décrivons dans les grandes lignes : une série de dépôts étanches et reliés commodément par des tuyaux, tout cela était construit en acier et servait d’échappement ; à la tête, on introduisait les copeaux de fer blanc avec du sodium pur ou un alliage de sodium et d’étain ; une fois hermétiquement fermé, l’appareil était réchauffé à 400-500º C dans un four à gaz ; on faisait le vide et on secouait le contenu, de sorte que l’étain se dissolvait en quinze minutes environ : En poursuivant la lixiviation en cycle continu, on obtient un alliage 50/50 ; il ne reste plus qu’à récupérer le sodium par distillation pour obtenir l’étain.
LES PROCÉDÉS ÉLECTROLYTIQUES
Au début, nous avons travaillé avec des électrolytes acides : acide sulfurique, sulfate acide de sodium et chlorures ; avec ce type d’électrolyte, les rendements étaient faibles et il a été rapidement abandonné. Aujourd’hui, seul l’électrolyte de base est utilisé, mais nous allons donner une petite idée de la façon dont il était utilisé dans le passé.
M. Gutensonn a travaillé avec un électrolyte d’acide sulfurique à 10% chauffé à 60ºC. Il formait l’anode avec les paquets de fer blanc placés dans des paniers en bois de 1200 x 300 x 800 mm. c’est-à-dire avec un volume de 0,288 mètre cube, tandis que les bains d’environ un mètre cube de capacité étaient construits avec du bois de pin ou de hêtre de 50 mm d’épaisseur, recouvert de 3,5 mm d’épaisseur de caoutchouc comprimé. Les cathodes étaient formées de feuilles de cuivre étamé de 1200 x 0,50 x 1,5 mm ; dans chaque bain, il y avait huit boîtes d’anodes et 16 boîtes de cathodes distantes de 100 mm. Les caractéristiques de fonctionnement étaient de 240 A, 15 V, ce qui devrait théoriquement permettre de séparer 4,15 kg d’étain par heure, mais le rendement pratique atteignait à peine 45 % car le reste du courant était consacré à la dissolution du fer et à la libération d’hydrogène, de sorte qu’on obtenait un étain assez pur.
Dans le processus alcalin, l’électrolyte est constitué de 10 % de NaOH, le reste restant ; maintenant, l’étain est mis en solution sous forme de stannate de sodium de formule SnO3Na2, très soluble, qui précipite sous forme de métal sur la cathode.
La précipitation est plus lente que la dissolution, de sorte que l’électrolyte s’enrichit progressivement en étain, bien qu’à une vitesse décroissante.
Un ennemi particulier du rendement actuel est l’avidité de la lessive de sodium dans l’électrolyte pour le dioxyde de carbone atmosphérique ; sous forme de carbonates de NaOH, elle perd son activité de dissolution et sa conductivité électrique, ce qui oblige à renouveler trop souvent l’électrolyte afin d’éliminer le carbonate de sodium formé et les impuretés dissoutes dans l’anode par caustification ; l’électrolyte doit être remué fréquemment pour que l’anode ne produise que des ions stanneux.
La température de travail est d’environ 70º C avec une densité anodique de 18 A/m2 et 100 A/m2 dans la région de la cathode, de sorte que si l’électrolyte contient 10 % d’alcalis libres, le rendement du courant anodique est de 94-95 %. Si l’électrolyse s’arrête soudainement, les ions stanneux disparaissent et il y a une augmentation immédiate de la tension aux bornes d’environ 0,7-1,2 V.
Maintenant, selon toute probabilité, le désétamage de l’alliage fer-étain commence ; la tension augmente rapidement jusqu’à 1,8 V et il ne reste que 0,08% d’étain dans la feuille, soit environ 2,40% de la quantité totale à récupérer ; le rendement du courant est maintenant de 88-89%, qui diminue à 82-83% lorsque la tension augmente à 2,5 V et il ne reste que 0,02% de Sn à récupérer, ce qui représente 0,05-0,06% de la quantité contenue principalement dans l’écrêtage.
La diminution du rendement électrique montre que le travail anodique se concentre principalement sur le fer ; il devient passif et libère de l’oxygène, ce qui réduit le rendement du courant.
La couleur du résidu anodique n’est ni déterminante ni indicative du degré de lixiviation de l’étain ; si avec une teneur de 0,28% de Sn il est gris bleuté et avec 0,02% de Sn rougeâtre, déjà avec 0,08% il montre une efflorescence rougeâtre.
En revanche, si l’électrolyte est totalement ou partiellement carbonaté ou si l’agitation n’est pas très vigoureuse, le degré de désétamage diminue peu, mais la tension aux bornes augmente et le rendement du courant diminue.
Le pourcentage d’étain dans l’électrolyte ne doit pas être supérieur à 2,34 %, sinon la saturation entrave l’attaque anodique et, comme conséquence désagréable, il peut se former de l’acide méthanolique hydraté insoluble – non récupérable – qui est perdu dans la boue anodique.
Le procédé alcalin est plus rapide et moins coûteux que le procédé acide et exige beaucoup de vigilance. L’avantage par rapport à la méthode de l’électrolyte acide est qu’elle produit un résidu d’acier très populaire dans les aciéries, tandis que le résidu anodique du procédé qui fonctionne avec l’électrolyte acide ne peut être utilisé que pour obtenir du sulfate ferreux.
Le procédé acide présente, en revanche, l’avantage que l’étain est mis en solution sous forme d’ion stanneux, de sorte qu’en théorie, avec la même quantité de coulombs, il faut séparer deux fois plus d’étain métal.
LE PROCÉDÉ DE LIXIVIATION SÈCHE DU CHLORE
Le mot lixiviation vient du latin : « Lixivia, -ae » nom féminin qui signifie lessive. Les Romains utilisaient ce terme pour désigner les jus distillés des raisins avant de les écraser, ou des olives avant de les broyer. Aujourd’hui, la lixiviation est le lavage d’une substance pulvérisée pour en extraire les parties solubles.
Proposé par Higgins et mis au point par Parmelee, Lambotte Goldsmitd et Weber, il a balayé industriellement les autres méthodes d’extraction car le chlore sec dissout facilement l’étain et permet de le séparer sous forme de chlorure stannique sans attaquer l’acier de support ; l’Allemagne récupère par ce procédé plus de 85% de la production de chutes.
Winteler obtient du chlorure stannique en faisant travailler le fer blanc dans des découpes à une température contrôlée de 40-50º, car dans cette plage de température, le chlore n’attaque pas le fer ; pour cela, il faut que la température dans le réacteur de lixiviation dépasse 100º C ; si par inadvertance du chlorure ferrique se forme, on dira en termes métallurgiques que « l’étain a été brûlé » ; il faut tenir compte du fait que la réaction :
2Cl2 + Sn = Cl4Sn
Il libère 127,25 Kcal/mol. de chlorure stannique formé, ce qui peut annuler la performance de lixiviation en raison de l’augmentation de la température qui se produit. Le point critique est centré sur l’entrée du chlore dans le réacteur ; en raison de la densité spécifique élevée des moles de chlore présentes, désireuses de réagir, il peut se former une légère couche de chlorure ferrique anhydre et cristallin qui, en raison de son hygroscopicité, absorbe l’humidité de l’enceinte et, à partir de ce moment, la dissolution du fer sous forme de trichlorure de fer peut se manifester avec une vitesse énorme dans toute la feuille ; ce problème a été résolu par Weber J. en refroidissant intensivement le réacteur, ce qui permet d’améliorer le processus et d’obtenir de l’eau chaude pour le lavage de la canette récupérée.
La technique de récupération de l’étain du fer-blanc est basée sur la propriété du chlore sec d’attaquer facilement l’étain et de respecter le fer de support tant qu’il n’y a pas de trace d’humidité dans le réacteur ; économiquement, elle ne peut pas être viable si l’on ne dispose pas de quantités suffisantes de chlore sec bon marché et avec ce procédé, en une seule opération, on obtient les deux composants du fer-blanc en même temps. D’une part, le chlorure stannique de grande valeur pour son application dans la teinture des fibres textiles – soie, etc. – et d’autre part, l’acier ou le fer doux parfaitement étamé avec moins de 0,1% de Sn. Par rapport aux autres méthodes de récupération, le procédé de désétamage à sec au chlore n’a que des avantages :
– Les premier et deuxième procédés présentés sont obsolètes, aux résultats incertains, ils nécessitent des installations coûteuses et le coût de l’étain récupéré n’est compensé que dans les conditions particulières d’un pays.
– L’électrolyse avec des électrolytes acides consomme trop d’énergie, puisque 50-35 % de la quantité totale fournie de nos jours est consommée dans le travail de dissolution du fer et de génération d’hydrogène ; les installations sont coûteuses, très exposées à subir des défaillances continues et graves comme toutes celles qui travaillent avec des liquides acides, de sorte que le rendement économique n’est pas brillant et l’étain trop cher pour être mis sur le marché.
– L’électrolyse de l’électrolyte basique présente certains avantages techniques par rapport à celle de l’électrolyte acide ; cependant, sa consommation énergétique élevée – 3 000 kWh/Tm – d’étain récupéré ne permet pas de maintenir le traitement au prix auquel le kWh est facturé et, comme elle nécessite une installation trop complexe, comme c’est le cas aujourd’hui, ce serait un miracle retentissant qu’elle puisse donner un rendement économique.
– Le désétamage par l’action du chlore sec sur le fer-blanc décolle élégamment et simplement le problème ; il nécessite peu de force installée, peu de personnel, peu d’immobilisation monétaire et le sous-produit peut être vendu aux aciéries sans problème après un simple lavage.
Le chlore liquide peut être trouvé sans grande difficulté – il est fabriqué par Solvay y Cia – le problème le plus difficile est d’établir une ligne congruente et fonctionnant bien pour la collecte des rognures de fer blanc.
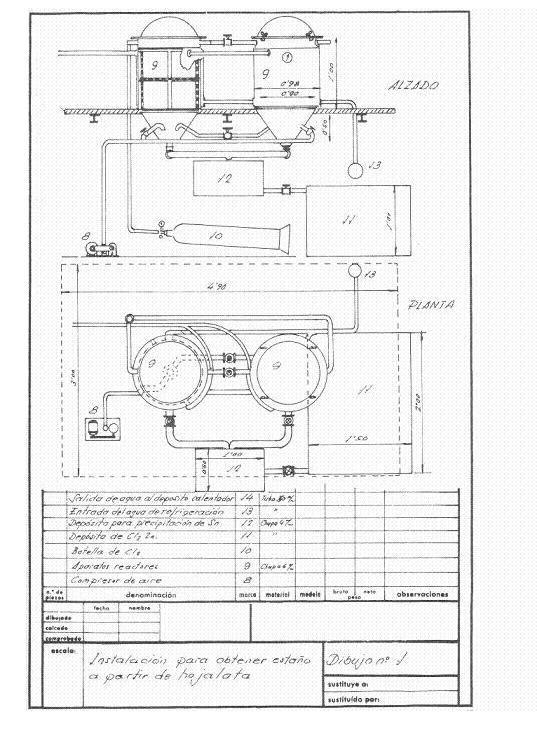
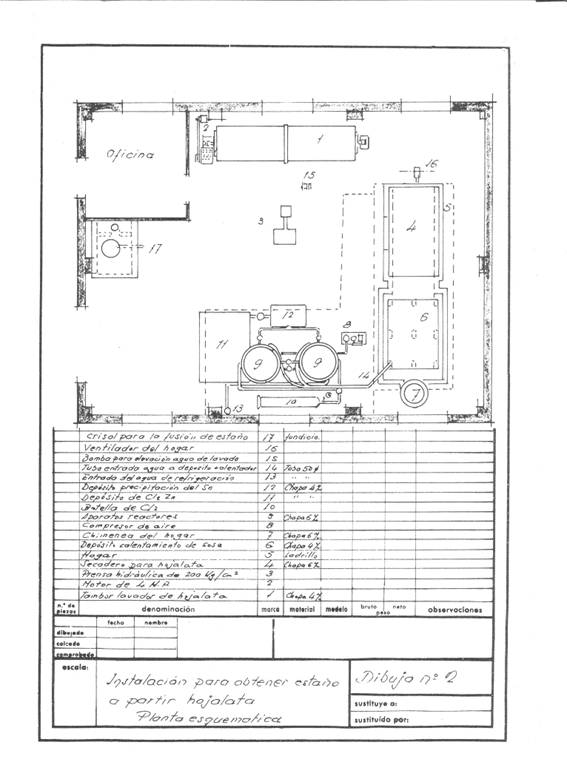
Les figures 1 et 2 donnent une idée de l’installation qui a été projetée ; on pensait qu’elle avait une fréquence de récupération de 4 tonnes de rognures par jour en travaillant en une équipe et on pensait qu’elle fonctionnerait en campagnes.
Figure n° 1 : Exemple 1 d’installation de désétamage
Figure n°2 : Exemple de 2ème installation de désétamage
Lorsque les chutes ont été reçues à l’usine, la première opération a consisté à les laver avec environ 2 mètres cubes d’une solution de carbonate de sodium de densité 11-12 Be, qui pèse 2160 kg et contient 1250 kg de soude cristalline – pureté 98% -, traitement dont la mission est de saponifier les déchets gras que les chutes peuvent contenir et d’éliminer les encres et les vernis.
La saponification est une réaction chimique entre un acide gras (ou un lipide saponifiable, porteur de résidus d’acides gras) et une base ou un alcali, dans laquelle le principal produit obtenu est le sel de l’acide et de la base. Ces composés ont la particularité d’être amphipathiques, c’est-à-dire qu’ils ont une partie polaire et une partie apolaire (ou non polaire), de sorte qu’ils peuvent interagir avec des substances aux propriétés différentes. Par exemple, les savons sont des sels d’acides gras et de métaux alcalins obtenus par ce procédé. La méthode de saponification dans l’aspect industriel consiste à faire bouillir la graisse dans de grandes marmites, à ajouter lentement de la soude caustique (NaOH), à remuer le mélange en continu jusqu’à ce qu’il commence à devenir pâteux.
Cette opération est effectuée dans un tambour rotatif d’une capacité d’environ 3,14 mètres cubes et utilise une surface de lavage d’environ 14,13 m2, construite en tôle de fer de 4 mm d’épaisseur et entraînée par un moteur de 4 CV.
Une fois l’opération de lavage terminée, la solution alcaline était décantée avec les savons dans une cuve d’environ 3 m3 de capacité, située au-dessus du four de séchage du fer-blanc pour le maintenir chaud et pouvoir l’utiliser à nouveau dans de nouveaux traitements jusqu’à son épuisement.
Les chutes sans graisse, sans vernis et sans encre sont rincées à l’eau chaude, qui est généreusement obtenue par le refroidissement des réacteurs de désétamage.
Les chutes propres sont pressées dans des paquets prismatiques de 400 x 170 x 200 mm, facilement maniables, car elles pèsent environ 50 kg, dans une presse hydraulique à environ 200 kg/cm2.
Ces colis sont séchés sous pression atmosphérique à environ 200º C pendant deux heures, avec une consommation moyenne de 150 kg de charbon à 7000 Kcal/kg. La chambre de séchage était une sorte de séchoir à étagères – sans grande entité – construit de « fortune », où un ventilateur moyen injectait de l’air chaud pour entraîner l’eau à travers la cheminée : tout était commodément isolé par une couche de magnésie de 85%, de 60 mm d’épaisseur et de 280 kg de poids, et avant de l’envoyer à l’atmosphère, on lui faisait céder les calories excédentaires pour chauffer les solutions du processus, la cheminée de 500 mm de diamètre dépassant à peine du toit.
Les réacteurs de désétamage étaient deux en série, et de l’air sec pouvait y être soufflé à volonté pour faire passer le chlore restant du réacteur fini à l’autre, de sorte que pendant le désétamage de l’un, le chlorure stannique et l’acier récupéré étaient extraits de l’autre.
Au début de la journée, les deux réacteurs ont été chargés avec les paquets d’étain pressés et séchés. Dans la première, le chlore sec était laissé à 2 atm. Lorsque la pression est réduite et que l’on laisse l’eau de refroidissement s’écouler, le chlore gazeux se dilate sur la surface libre du réacteur et agit sur l’étain du fer-blanc ; celui-ci absorbe continuellement le chlore tant qu’il n’y a pas d’étain ayant réagi, et lorsque tout l’étain a été transformé en chlorure stannique, la pression reste constante et l’attaque est terminée. Après un intervalle de temps approprié, l’appareil est soufflé avec de l’air sec pour évacuer l’excès de chlore dans le réacteur préservé, qui une fois fermé commence à fonctionner, tandis que du réacteur fini tout le chlorure stannique formé est soufflé par le fond, et quand il ne goutte plus, la masse d’acier désétamée est retirée, bien lavée avec une solution chaude de carbonate de sodium, puis rincée avec l’eau chaude du réacteur et un résidu d’acier doux très avantageux est obtenu pour les aciéries. En travaillant de cette manière, nous avons récupéré 251 kg de chlorure stannique et consommé 230-240 kg de chlore.
Ce chiffre de chlorure stannique récupéré représente une récupération de 115 kg d’étain métallique, soit un rendement de récupération de 96 %, de sorte que le fer résiduel ne contient que 0,10-0,13 % d’étain, ce qui permet de l’envoyer sans problème aux aciéries.
Comme la réaction de dissolution est très exothermique, le refroidissement doit être soigneusement surveillé pour obtenir un bon rendement : sinon, il y a un certain risque de brûler la boîte.
Le chlore liquide est disponible dans le commerce dans des bouteilles en acier semblables à celles de l’oxygène, de l’acétylène, du dioxyde de carbone, etc. ; elles contiennent 50 kg de poids net à 6 atm et chaque kilogramme de chlore liquide fournit 334 litres de chlore gazeux sec.
Pendant le temps de travail, nous utilisions 5 bouteilles par jour pour lixivier les 4 Tm de boutures ; nous laissions le chlore liquide passer de 6 à 2 atm, pour lequel nous utilisions un régulateur de pression commercial.
Comme l’étain métallique était alors en pénurie, nous avons également mis au point un procédé de réduction du chlorure stannique. Pour ce faire, nous avons pensé commencer une réduction électrolytique sans dépense de courant et avec une installation minimale ; cela semble une contradiction, mais après les tests pertinents, l’idée n’était pas déraisonnable, nous devions seulement développer une utilisation de la différence de tension existante entre le zinc et l’étain. En étudiant le problème, nous sommes arrivés à une certitude : nous avons vu qu’une feuille de zinc introduite dans une solution de chlorure stannique légèrement acidifiée par de l’acide chlorhydrique (pH=5-6), a effectué les travaux suivants :
Cl4Sn + 2 Zn = 2 Cl2Zn + Sn
Cl4Sn + Sn = 2 Cl2Zn
2 Cl2Sn + 2 Zn = 2 Cl2Zn + 2 Sn
On considère donc que tout le zinc est dissous et que tout l’étain précipite sous une forme spongieuse de caractère métallique, qui est recueillie, lavée et refondue pour obtenir des lingots.
D’après les réactions écrites, 65 kg de zinc sont nécessaires pour récupérer tout l’étain du chlorure stannique formé. Nous utilisions des tôles de zinc de 1 mm d’épaisseur qui ont un poids au mètre carré de 6,9 kg et nous avions donc besoin d’environ 9,5 mètres carrés de tôle de zinc par jour.
Nous avons fait une installation « fortune » pour elle. Nous avons construit un conteneur de 1000 x 600 x 500 mm et y avons placé des tôles de zinc suspendues à des cadres en bois. Une fois les précipitations terminées, nous avons pris l’éponge en étain avec des pales en bois, nous les avons enlevées et bien lavées à l’eau chaude et nous les avons fait fondre facilement dans un creuset en fer à 231,5º C avec une consommation de charbon de 6-7 % d’une boulette de 7000 Kcal/kg.
Une fois fondu, le liquide était éliminé au moyen de branches de bois vert pour désoxyder ; les scories étaient enlevées et le liquide purifié était introduit dans des lingotières, ce qui permettait d’obtenir un métal d’une pureté de 99,3 à 99,7 % adapté au soudage et à la fabrication de bronzes et d’autres alliages.
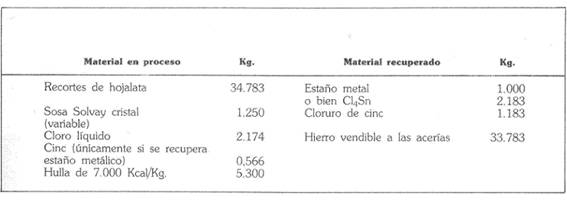
Le tableau suivant est un bref bilan matière de l’opération, établi pour une production d’une tonne de métal, équivalent à 2 183 kg de chlorure stannique ».












0 Comments