1. EINLEITUNG: DAS WESEN DER KORROSION IN METALLVERPACKUNGEN
Korrosion wird technisch als die langsame Zerstörung eines Metalls durch die Einwirkung eines äußeren Agens definiert, die zu einem chemischen oder physikalisch-chemischen Angriff führt. Obwohl Metalle in der Regel stabile Elemente sind, durchbricht das Eingreifen von äußeren Einflüssen dieses Gleichgewicht. Im Zusammenhang mit Metallverpackungen, insbesondere Weißblech, ist dieses Phänomen entscheidend für die Produktintegrität und die Lebensmittelsicherheit.
Alle Metalle stehen in Kontakt mit der Luft, die zu 79 % aus Stickstoff und zu 21 % aus Sauerstoff besteht. Da Stickstoff ein inertes Gas ist, entfällt die aggressive Wirkung der Atmosphäre auf die Metalle fast ausschließlich auf den Sauerstoff. Damit der Korrosionsprozess jedoch ausgelöst wird und fortschreiten kann, benötigt der Sauerstoff „Mitarbeiter“:
- Die Wärme: Die zusammen mit dem Luftsauerstoff die Oberflächenoxidation erzeugt.
- Die Feuchtigkeit: Die in Kombination mit Sauerstoff die eigentliche Korrosion verursacht.
2. ELEKTROCHEMISCHE GRUNDLAGEN UND DAS GALVANISCHE ELEMENT
Um die Korrosion in Verpackungen zu verstehen, ist es unerlässlich, das elektrochemische Verhalten von Metallen zu verstehen. Metalle werden nach ihrem elektrischen Potenzial eingeteilt:
- Anodisch: Metalle mit negativem Potenzial, die dazu neigen, Elektronen abzugeben und leicht zu oxidieren.
- Kathodisch: Metalle mit positivem Potenzial (wie Edelmetalle), die positive Ionen anziehen und korrosionsbeständig sind.
Wenn zwei verschiedene Metalle in Gegenwart eines Elektrolyten miteinander verbunden werden oder in Kontakt treten, bildet sich ein galvanisches Element. In dieser Situation oxidiert das Metall mit dem niedrigeren Potenzial (das anodischste).
2.1. Der Sonderfall Weißblech (Eisen und Zinn)
Weißblech weist ein faszinierendes duales Verhalten auf, je nachdem, ob die Exposition intern (ohne Sauerstoff) oder extern (mit Sauerstoff) erfolgt.
A) Im Inneren der Verpackung (Sauerstoffmangel): Zinn (Sn) wirkt als Anode gegenüber Eisen (Fe).
- Reaktion: Sn⁰ ⇔ Sn⁺² + 2e⁻ (E₀ = -0,13 V).
- Eisen: Fe⁰ ⇔ Fe⁺² + 2e⁻ (E₀ = -0,44 V).
- Das Zinn oxidiert und schützt das Eisen. Dieses Phänomen impliziert eine Entzinnung, erhält aber die strukturelle Integrität des Grundstahls.
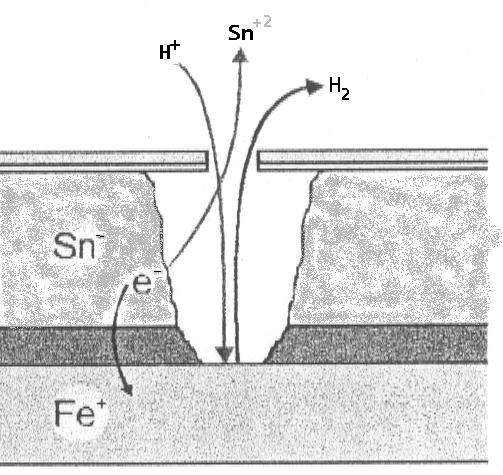
B) Auf der Außenseite der Verpackung (Sauerstoff vorhanden): Es kommt zu einer Polaritätsumkehr. Das Eisen verhält sich wie eine Anode und oxidiert gegenüber dem Zinn, das als Kathode wirkt.
- Das Eisen ist in dieser Umgebung stärker elektronegativ und unterliegt der Korrosion.
- Dies führt zur Bildung von Eisenoxiden und -hydroxiden (dem bekannten „Rost“), deren Farbe je nach Hydratation von gelb bis orange variiert.
Die chemischen Reaktionen der Eisenoxidation sind: Fe → Fe²⁺ + 2e⁻ (von Metall zu Eisenion) Fe²⁺ → Fe³⁺ + e⁻ (von Eisen- zu Eisenion)
In Gegenwart von Luftfeuchtigkeit ist das Endprodukt das hydratisierte Eisen(III)-oxid von orangerot: 2 Fe₂O₃ + 6H₂O → 4 Fe(OH)₃
3. KLASSIFIZIERUNG DER KORROSIONSARTEN
Korrosion kann in drei Hauptkategorien eingeteilt werden, je nach dem äußeren Agens, das sie auslöst.
3.1. Elektrochemische Korrosion Sie ist die häufigste bei Metallen, die feuchten Atmosphären ausgesetzt oder in Wasser getaucht sind. Sie wird durch die oben genannten galvanischen Reihen bestimmt. Ein klassisches Beispiel ist das Verhalten von Eisen gegenüber Zink oder Zinn:
- Gegenüber Zink (Zn= -0,763 V) ist Eisen (Fe= -0,440 V) geschützt, weil Zink anodischer ist.
- Gegenüber Zinn (Sn= -0,135 V) wird Eisen angegriffen.
Das Vorhandensein von Salzen wie Natriumchlorid (NaCl) beschleunigt diesen Prozess gemäß der Reaktion: 2 ClNa + 2 H₂O ↔ 2 HCl + 2 NaOH Das Salz reagiert, wird aber nicht zerstört, wodurch der Korrosionsprozess so lange fortgesetzt wird, wie Metall und Feuchtigkeit vorhanden sind.
3.2. Chemische Korrosion Verursacht durch den direkten Angriff von Säuren und Laugen.
- Säuren: Eisen wird von nicht oxidierenden Säuren angegriffen. Das Vorhandensein von Schwefel ist besonders gefährlich, da er Eisensulfid bildet und als Katalysator wirkt, was die Verwendung von schwefelhaltigen Verbindungen in Verpackungen riskant macht.
- Laugen: Greifen Metalle wie Aluminium und Zinn an. Zinn bildet lösliche Natriumstannite, die die Schutzschicht bis zur vollständigen Zerstörung der Beschichtung auflösen.
3.3. Mikrobiologische Korrosion Ist eine der am wenigsten bekannten, aber höchst zerstörerischen Formen. Sie wird durch die Wirkung von Folgendem verursacht:
- Anaeroben Bakterien: Erzeugen korrosive Stoffwechselprodukte.
- Aeroben Bakterien: Produzieren korrosive Mineralsäuren.
- Pilze: Verursachen organische Stoffwechselsäuren.
Der Stoffwechsel dieser Mikroorganismen erzeugt Gase (CO₂, H₂, N₂) und Substanzen wie Ammoniak, Sauerstoffwasser und Sulfide, wodurch eine hochaggressive Mikroumgebung für die Verpackung entsteht.
4. AUSBREITUNG UND MORPHOLOGIE: LOKALISIERTE KORROSION
Obwohl es eine gleichmäßige Korrosion gibt (die die gesamte Oberfläche betrifft), ist diese in beschichteten Verpackungen selten. Die häufigste Form in Weißblech ist die lokalisierte Korrosion, die bestimmte Bereiche angreift und andere intakt lässt, im Allgemeinen aufgrund von Fehlern oder Porosität in der Beschichtung (Lack oder Zinn).
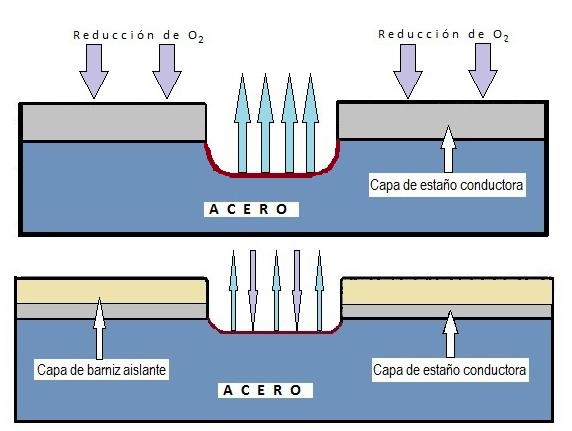
Es gibt verschiedene Arten von lokalisierter Korrosion von besonderer Bedeutung:
4.1. Interkristalline Korrosion Betrifft die Verbindung der Körner in der Kristallstruktur des Metalls, schwächt seine mechanische Festigkeit und verursacht unregelmäßige Brüche. Sie ist in Verpackungen nicht die häufigste.
4.2. Spaltkorrosion Tritt in Zwischenräumen oder versteckten Bereichen auf, in denen kleine Mengen korrosiver Lösungen (Salze oder Säuren) stagnieren. Sie ist typisch für die Verschlüsse von Verpackungen oder unter den Ringen zum einfachen Öffnen.
4.3. Filiformkorrosion Dies ist eine oberflächliche Variation, die unter nichtleitenden Beschichtungen (Lacken) auftritt. Sie ist dadurch gekennzeichnet, dass sie schmale Filamente (0,05 bis 3 mm breit) bildet, die sich unter dem Lack schlängeln.
- Mechanismus: Funktioniert durch differentielle Belüftung. Der „Kopf“ des Filaments ist der anodische Bereich (wo die Korrosion beginnt und es zur Versauerung kommt) und der „Schwanz“ ist der am stärksten belüftete Bereich.
- Faktoren: Erfordert eine relative Luftfeuchtigkeit von mehr als 60 % und das Vorhandensein von Salzen (Chloride) als Initiatoren.
- Prävention: Die Qualität oder Menge des Lacks verhindert nicht seine Bildung; der Schlüssel ist, die Luftfeuchtigkeit niedrig zu halten und salzhaltige Rückstände zu vermeiden.

4.4. Lochfraßkorrosion (Pitting) Ist die häufigste und gefährlichste Form der lokalisierten Korrosion. Sie entsteht in Unvollkommenheiten oder schlecht belüfteten Bereichen (unter Ablagerungen). Ihre Gefahr liegt darin, dass sie das Metall in der Tiefe durchbohrt und manchmal von außen mit bloßem Auge fast unsichtbar ist. Die Lochfraßkorrosion kann verschiedene Morphologien annehmen (schmal und tief, elliptisch, in Galerien usw.).
4.5. Spannungsrisskorrosion (SCC) Beinhaltet einen spröden Bruch des Metalls aufgrund der Kombination von drei gleichzeitigen Faktoren:
- Zugspannung (Stress).
- Ein spezifisches korrosives Medium.
- Ein anfälliges Metall.
Der Prozess besteht aus zwei Phasen: der Bildung eines anfänglichen Risses und seiner Ausbreitung bis zum Bruch des Materials. Dies ist häufig in Bereichen mit Tiefziehen oder in den Nieten der leicht zu öffnenden Deckel zu beobachten.
4.6. Wasserstoffschaden Verursacht durch die Diffusion von Wasserstoff in das Metall, die oft durch Sulfidionen aus der Zersetzung von Proteinen (Thioproteine) im Lebensmittel beschleunigt wird. Grundreaktion: 2 H⁺ + 2 e⁻ → H₂↑
5. FAKTOREN DES HERSTELLUNGS- UND VERPACKUNGSPROZESSES
Die äußere Korrosion ist nicht nur ein Materialproblem, sondern auch ein Prozessproblem. Mehrere Phasen beeinflussen die Anfälligkeit der Verpackung:
5.1. Mechanische Beschädigungen und Befüllung
- Zuführleitungen: Reibung und Stöße beschädigen den Außenlack und legen den Grundstahl frei.
- Verschluss: Die Einstellung der Verschließmaschinen ist entscheidend. Schlecht geschmierte Rollen oder nicht eingestellte Dorne können die Beschichtung im Bereich des Verschlusses beschädigen.
- Befüllung: Produktrückstände auf der Verpackung verunreinigen das Sterilisationswasser und erhöhen seine Aggressivität.
5.2. Sterilisation und Kühlung Während der Wärmebehandlung im Autoklaven:
- Es wird empfohlen, Trennwände zwischen den Schichten zu verwenden, um Reibung in der Hitze zu vermeiden.
- Die für den Gegendruck verwendete Luft liefert korrosiven Sauerstoff.
- Die direkte Einleitung von Dampf kann alkalische Kondensate aus den Kesseln mitreißen, die den Lack angreifen.
- Trocknung: Es ist wichtig, dass die Endtemperatur der Verpackung die „Selbsttrocknung“ ermöglicht. Die Restfeuchtigkeit im Deckelbehälter oder unter dem Ring ist ein Nährboden für galvanische Zellen.
6. WASSERQUALITÄT: EIN ENTSCHEIDENDER FAKTOR
Das Prozesswasser (Sterilisation und Kühlung) kann korrosiv oder inkrustierend sein. Wichtige zu kontrollierende Parameter:
- pH-Wert: Saure oder sehr alkalische Medien greifen Metall und Lack an. Idealer Bereich: 6,5 – 8,5.
- Leitfähigkeit: Hohe Werte (< 2000 µS/cm empfohlen) fördern den Stromfluss in den galvanischen Zellen.
- Chloride und Sulfate: Sollten unter 25 mg/l gehalten werden.
- Trockenrückstand (TDS): Weniger als 500 mg/l.
6.1. Bewertungsindizes für Wasser Um das Verhalten von Wasser vorherzusagen, werden spezifische Indizes verwendet:
A) Langelier-Index (LSI): Bewertet das Gleichgewicht des Calciumcarbonats. Formel: LSI = pH – pHs
- Ein negativer LSI (< -0,4) deutet auf korrosives Wasser hin.
- Ein positiver LSI (> 0,2) deutet auf inkrustierendes (ausfällendes) Wasser hin.
B) Ryznar-Index (RSI): Formel: RSI = 2(pHs) – pH
- Werte >> 7 oder 8 deuten auf hohe Korrosivität hin.
- Werte << 6 deuten auf eine Tendenz zur Inkrustierung hin.
Inkrustierungen (weiße Flecken von Carbonaten) sind nicht nur ein ästhetisches Problem; sie wirken als Feuchtigkeitsspeicherbereiche und fördern die spätere Korrosion.
6.2. Passivierungsbehandlungen Um die Aggressivität des Wassers zu mildern, werden kathodische Inhibitoren (Passivierungsmittel) auf Basis von Zink und Phosphorsäure zugesetzt. Diese erzeugen eine oberflächliche Phosphatierung auf dem Stahl, die ihn schützt. Es ist wichtig, die Dosis zu kontrollieren, da ein Überschuss die Leitfähigkeit und paradoxerweise die Aggressivität des Wassers erhöht.
7. LAGERUNG UND TRANSPORT: UMWELTKONTROLLE
Sobald die Verpackung hergestellt und verarbeitet wurde, besteht weiterhin ein Risiko. Die äußere Korrosion während der Lagerung und des Transports ist in der Regel auf Kondensation und das Vorhandensein von hygroskopischen Salzen zurückzuführen.
7.1. Lagerbedingungen
- Relative Luftfeuchtigkeit (RH): Sollte niedrig gehalten werden (unter 60 %, um Filiformkorrosion zu vermeiden).
- Temperatur: Vermeiden Sie plötzliche Änderungen, die zum Taupunkt und zur Kondensation führen.
- Salzgehalt: Salzablagerungen ziehen Feuchtigkeit aus der Umgebung an (Hygroskopizität) und leiten die Korrosion ein.
- Verpackungsmaterialien: Karton und Trennwände sind nicht inert; sie müssen analysiert werden, um sicherzustellen, dass sie keine aggressiven Salze enthalten. Die Verwendung von durchgehendem Kunststoff kann kontraproduktiv sein, wenn er die innere Feuchtigkeit zurückhält.


7.2. Das Phänomen der Kondensation (Taupunkt) Das Kondensationsrisiko hängt vom Verhältnis zwischen Temperatur und relativer Luftfeuchtigkeit ab. Wenn die Temperatur plötzlich sinkt, kondensiert der überschüssige Dampf als flüssiges Wasser auf den kalten Verpackungen.
Kritische Beispiele für den zulässigen Temperaturabfall vor der Kondensation (für anfängliche Luft bei 35 ºC):
- Bei 20 % RH: Die Temperatur muss um 28 ºC (bis 7 ºC) sinken, um zu kondensieren (geringes Risiko).
- Bei 50 % RH: Es reicht aus, wenn sie um 12 ºC (bis 23 ºC) sinkt.
- Bei 75 % RH: Wenn sie nur um 5 ºC (bis 30 ºC) sinkt, kommt es zu Kondensation (sehr hohes Risiko).
Dies ist im Seeverkehr von entscheidender Bedeutung, wo Container großen Temperaturschwankungen ausgesetzt sind.
7.3. UV-Schutz Ultraviolette Strahlung (Sonnenlicht oder von Leuchtstoffröhren in Insektenvernichtern) baut Lacke und Lithografien ab und schwächt die äußere Schutzbarriere.
8. SCHUTZMETHODEN UND SCHLUSSFOLGERUNG
Der Kampf gegen die Korrosion basiert auf Prävention. Zu den grundlegenden Strategien gehören:
- Die Integrität des Lacks erhalten: Ein gebrochener Lack konzentriert den anodischen Angriff.
- Hygroskopische Rückstände entfernen: Gründliche Reinigung der Verpackungen nach dem Verschließen.
- Absolute Trocknung: Vermeiden Sie Wasser in Spalten (Verschlüsse, Ringe).
- Umweltkontrolle: Trockene, belüftete und temperaturgeregelte Lager, um den Taupunkt zu vermeiden.
- Verwendung von Inhibitoren: Chemische Behandlung des Prozesswassers (Passivierung).
Zusammenfassend lässt sich sagen, dass die Korrosion in Metallverpackungen ein multifaktorielles Phänomen ist, das Chemie, Metallurgie und atmosphärische Physik umfasst, dessen Kontrolle von der integralen Verwaltung des gesamten Lebenszyklus der Verpackung abhängt.