РЕЗЮМЕ
Описание различных промышленных процедур по восстановлению олова, содержащегося в отбросах жести, отбракованных металлургической промышленностью. Из них можно сделать вывод, что действительно интересным является тот, кто получает это олово сухим способом путем выщелачивания хлором.
ВВЕДЕНИЕ
Жесть является наиболее специфическим компонентом жести, что придает ей основную характеристику: устойчивость к коррозии под действием внешних элементов. Это металл с высокой ценой на рынке, так как его добыча из руды, помимо дороговизны, очень сильно контролируется крупными транснациональными компаниями, которые стремятся сохранить высокую цену и дефицит предложения в условиях значительного спроса. По этой причине, в определенные периоды и в определенных географических регионах, часто интересно рассмотреть вопрос о восстановлении этого металла из отбросов жести с упаковочных заводов. Поэтому мы считаем интересным частично воспроизвести статью Педро Лопеса Гомеза, опубликованную в журнале «Técnica Industrial» под заголовком «ВЗАИМООТНОШЕНИЕ СТАННИША С СТАННИША С СТАННИША».
«Содержание олова в жести варьируется от 2% в толстом листе до 4,5% в тонком. Как общий критерий, вырубка, не содержащая, по крайней мере, 2% олова, не может быть экономически выгодной.
Опоры из матинированной стали — сердцевина жести — должны быть чрезвычайно дезактивированы, чтобы их можно было повторно использовать в качестве лома. Наличие олова, даже в небольших количествах, оказывает значительное влияние на пластичность стали, а содержание 0,3% Sn достаточно для того, чтобы сделать ее хрупкой и непригодной для использования в качестве восстановительной стали.
Как известно, жесть образуется внешним слоем почти чистого олова, легко отделяемого; под ней находится еще один кристаллический слой, образованный настоящим сплавом олова-железа, который труднее отделить, так как он сильно прилипает к опорному листу и трудно поддается атаке.
ПОДГОТОВИТЕЛЬНЫЕ РАБОТЫ
Перед применением любого метода лужения необходимо тщательно очистить обрезки жести и удалить как можно больше жира, красок, лаков и органических остатков.
Для этого перфорированные упаковки готовятся и подвергаются своего рода низкотемпературному предварительному плавлению, чтобы удалить как можно больше олова. Перед этой операцией необходимо удалить лак, покрывающий обрезки. Для этого лак легко растворяется в 10% щелочной соде Solvay или едкой щелочи; если наблюдается остаток эмали, то пакеты жести проходят через роликовый каландр, расположенный таким образом, что один из цилиндров работает с большей скоростью, чем другой, что приводит к волнистости пакета и отрыву эмали.
На рынке представлено оборудование, такое как «Goldschmidt TH», которое выдавливает и перфорирует обрезки с помощью цилиндров с шипами, и насыщает жиры и лаки 3% щелочью натрия в течение пятнадцати — тридцати минут в автоклаве при температуре 110-115°C, затем промывает горячей водой для удаления мыла и остатков щелочи, а затем в течение получаса нагревает при температуре 500°C для восстановления внешнего слоя олова, тем самым разрушая органические вещества — уплотняющие десны — и снова выдавливает.
В этой операции он очень старался не образовывать петухов из органических веществ, которые впоследствии будут препятствовать проникновению разрыхлителей.
Известные процессы разукрупнения можно разделить на четыре основные группы:
a) — Мокрые химические процессы.
б) — сухие металлургические процессы
в) — электролитические процессы посредством растворения в кислотах или щелочах.
г) — процессы с использованием сухого хлора
Мы посмотрим на каждого из них внизу.
ВЛАЖНЫЕ ХИМИЧЕСКИЕ ПРОЦЕССЫ
Восстановление олова из оловянной жести долгое время испытывалось с использованием химических процессов растворов кислот, щелочей или солевых растворов, настаивая на продолжении его использования для получения низких урожаев в каждом конкретном случае.
Кект и Хетте начали этот путь с целью последующего электролиза; но Goldsch-Midt показал, что когда олово растворяется кислотами, одновременно растворяется железо, которое трудно и дорого отделить. Щелочи сами по себе или с добавлением окислителей не воздействуют на железо, но и не полностью удаляют олово, так что листовая сталь также не может быть использована промышленным способом.
Schulze обрабатывает жесть раствором колючего хлорида; растворяет металлическое олово, чтобы превратить его в колючую соль:
Cl4Sn + Sn = 2 Cl2Sn
А затем проходит водяной пар, который осаждает сплав оксихлорида и регенерирует сплав хлорида, который возвращается в цикл:
6 Cl2Sn + 2 H2O + O2 = 4 ClSnOH + 2 Cl4Sn
Выделенный ClSnOH фильтруется и превращается в станический оксид SnO2 путем красного окисления в присутствии воздуха с выделением хлора, который рекуперируется:
4 SnClOH + 3 O2 = 4 SnO2 + C l2 + 2 H2O
Хлорид железа также использовался вместо хлорида станника в качестве растворителя, так как при избытке Cl3Fe олово окисляется и железо восстанавливается:
4 Cl3Fe + Sn = Cl4Sn + 4 Cl2Fe
Когда почти весь хлорид железа окисляет олово до уровня хлористого сплава, он восстанавливается при избытке олова до уровня хлористого сплава.
Cl4Sn + Sn = 2 Cl2Sn
Что с водяным паром превращается в основной стандартный хлорид, и при последующем кальцинировании мы получим стандартный оксид и восстановим хлор, необходимый для регенерации хлористого железа путем окисления Cl2Fe:
2 Cl2Fe + Cl2 = 2 Cl3Fe
Который возвращается к циклу выщелачивания; в обоих случаях окись станника восстанавливается до металла в соответствующей печи.
Райнекен-Понсгеникопп обрабатывает отходы жести во вращающихся барабанах с PbO — оксидной блохой — и водяным паром, при этом ему удается — в присутствии ранее добавленной содовой щелочи — образовывать натриевый станнат SnO3Na2.3H2O и отделять свинцовый металл.
Станнат натрия может быть выведен на рынок в концентрате или кристаллическом виде, либо в последующей операции олово может быть выпало в осадок с помощью газообразной струи углекислого газа с последующим восстановлением в реверберационной печи.
СУХИЕ МЕТАЛЛУРГИЧЕСКИЕ ПРОЦЕССЫ
Этот процесс сводится к разделению олова путем плавления и окисления, частично к «золе олова», которая восстанавливается в реверберационной печи или растворяется в расплавленном металле, или к непосредственному образованию солей, или к использованию металла путем простого плавления и механического разделения жидких капель олова.
Например, Laroque смешивает отходы жести с древесным углем — в котором почти нет золы — и хлоридом натрия, а Edmunds расплавляет отбросы жести при температуре, достаточной для разжижения олова в центрифуге, оснащенной специальным очагом в центре, где капли расплавленного олова разделяются центробежной силой.
Вольтерез обрабатывает отходы жести в ретортах с паром, нагретым до 450-500º C, для отделения олова от железа путем плавления; в этих условиях олово не окисляется, так как подвергается восстановительному действию водорода, образующегося при восстановлении пара на нагретом железе; на внешнем слое жидкого олова может быть обнаружена только слабая пленка окиси, причем нечасто; Были также опробованы процессы, которые заставляют расплавленный натрий действовать на обрезки жести; их преимущество заключается в том, что они полностью растворяют жесть, оставляя стальную резку в отличных условиях, так что при простой ковке она может быть использована снова, но процесс сложен, раздражает и опасен, как можно судить по ходу процесса, который мы описываем в общих чертах: Серия водонепроницаемых отложений, удобно соединенных с трубами, все это было выполнено из стали и работало как выхлоп; в голову жесть вводилась вырезка вместе с чистым натрием или натриево-оловянным сплавом; после герметичного закрытия аппарат нагревался до 400-500ºC в газовой печи; создавался вакуум и содержимое встряхивалось, так что олово растворялось примерно за пятнадцать минут: Продолжая выщелачивание в непрерывном цикле, достигается сплав 50/50; теперь остается только восстановить натрий путем дистилляции для получения олова.
ЭЛЕКТРОЛИТИЧЕСКИЕ ПРОЦЕССЫ
Вначале мы работали с кислотным электролитом: серной кислотой, сульфатом натрия и хлоридами; с этим типом электролита урожайность была низкой, и вскоре он был заброшен. Сегодня используется только основной электролит, но мы дадим некоторое представление о том, как он использовался в прошлом.
Гутенсонн работал с электролитом 10% серной кислоты, нагретым до 60ºC. Он формировал анод с пакетами жести, помещенными в деревянные корзины размером 1200 х 300 х 800 мм, то есть объемом 0,288 куб. м, в то время как ванны емкостью около одного куб. м строились из сосновой или буковой древесины толщиной 50 мм, покрытой 3,5 мм толщиной прессованной резины. Катоды были сформированы из луженых медных листов размером 1200 x 0.50 x 1.5 мм; в каждой ванне было по восемь анодных коробок и 16 катодных коробок на расстоянии 100 мм друг от друга. Рабочие характеристики составили 240 A, 15 V, которые теоретически должны были отделить 4,15 кг олова в час, но практический выход едва достигал 45%, так как остальная часть тока тратилась на растворение железа и выделение водорода, так что получалось довольно чистое олово.
В щелочном процессе электролит составляет 10% NaOH, остальное остается, теперь олово переходит в раствор в виде натрия станната формулы SnO3Na2, очень растворимого, который осаждается на катоде в виде металла.
Осадки выпадают медленнее, чем растворяются, поэтому электролит постепенно обогащается оловом, хотя и со снижающейся скоростью.
Особым врагом эффективности тока является вялость щелочи натрия в электролите для углекислого газа в атмосфере; так как NaOH карбонат теряет активность растворения и электропроводность, что делает необходимым слишком частое обновление электролита для устранения образовавшегося карбоната натрия и примесей, растворенных в аноде путем каустизации; электролит необходимо часто перемешивать так, чтобы анод выделял только ионы снотворного.
Рабочая температура составляет около 70º C при плотности анода 18 А/м2 и 100 А/м2 в катодной области, так что если электролит содержит 10% свободных щелочей, то эффективность анодного тока составляет 94-95%. Если электролиз внезапно прекращается, то исчезают звездные ионы, и мгновенно повышается конечное напряжение примерно на 0,7-1,2 В.
Теперь, по всей вероятности, начинается лужение сплава железо-олово; напряжение быстро возрастает до 1,8 В и в листе остается только 0,08% олова, т.е. примерно 2,40% от общего количества, подлежащего восстановлению; КПД тока теперь 88-89%, который снижается до 82-83% по мере роста напряжения до 2,5 В и только 0,02% Sn, подлежащего восстановлению, что составляет 0,05-0,06% от количества, содержащегося в первую очередь в обрезке.
Снижение электрической эффективности показывает, что анодная работа в основном сосредоточена на железе; оно становится пассивным и выделяет кислород, что снижает токовую эффективность.
Цвет анодного остатка не является ни определяющим, ни свидетельствующим о степени выщелачивания олова; если при содержании 0.28% Sn он голубовато-серый, а при содержании 0.02% Sn красноватый, то уже при содержании 0.08% он проявляет красновато-рыжее пятно.
С другой стороны, если электролит полностью или частично газируется или перемешивание не очень интенсивное, то степень дезактивации уменьшается незначительно, но напряжение на клеммах возрастает, а КПД тока снижается.
Процент олова в электролите не должен превышать 2,34%, в противном случае насыщение препятствует анодному воздействию и как неприятное последствие может образовываться нерастворимая гидратированная метаноловая кислота — невосстанавливаемая — которая теряется в анодном осадке.
Щелочной процесс быстрее и дешевле, чем кислотный, и требует большой бдительности. Преимущество по сравнению с кислотным электролитом заключается в том, что он производит стальной остаток, который очень популярен на сталелитейных заводах, в то время как анодный остаток процесса, который работает с кислотным электролитом, может быть использован только для получения сульфата черных металлов.
Кислотный процесс, с другой стороны, имеет то преимущество, что олово поступает в раствор в виде стеблевого иона, так что теоретически с одним и тем же количеством куломбов в два раза больше металла олова должно быть отделено.
СУХОЕ ХЛОРНОЕ ВЫЩЕЛАЧИВАНИЕ
Слово «выщелачивание» происходит от латинского: «Lixivia, -ae» женское существительное, означающее щёлок. Римляне использовали этот термин для обозначения соков, дистиллированных из винограда перед его дроблением, или оливок перед его измельчением. В настоящее время выщелачивание — это промывка измельченного вещества для извлечения растворимых частей.
Предложенный Хиггинсом и усовершенствованный компаниями Parmelee, Lambotte Goldsmitd и Weber, он промышленно переработал другие методы извлечения, так как сухой хлор легко растворяет олово и позволяет отделить его в виде стандартного хлорида, не воздействуя на несущую сталь; Германия восстанавливает с помощью этого процесса более 85% производства обрезков.
Winteler получает хлорид станника, заставляя сухой хлор работать на жести в черенках при контролируемой температуре 40-50º, так как в этом температурном диапазоне хлор не атакует железо; для этого необходимо, чтобы температура в выщелачивающем реакторе превышала 100º C; если по надзору образуется хлорид железа, то в металлургических терминах будет сказано, что «олово сгорело»; необходимо учитывать эту реакцию:
2Cl2 + Sn = Cl4Sn
Он выделяет 127,25 Ккал/моль. образовавшегося станического хлорида, который может свести на нет эффективность выщелачивания из-за повышения температуры. Критическая точка сосредоточена на входе хлора в реактор; из-за высокой удельной плотности присутствующих молекул хлора, стремящихся к реакции, может образовываться легкий слой безводного кристаллического хлористого железа, который благодаря своей гигроскопичности поглощает влажность корпуса, и с этого момента растворение железа в виде трихлорида железа может проявляться с огромной скоростью по всему листу; эту проблему решил Вебер Дж. путем интенсивного охлаждения реактора, улучшая тем самым процесс и получая горячую воду для промывки регенерируемого баллона.
Метод извлечения олова из жести основан на свойстве сухого хлора легко атаковать олово и уважать поддерживающее железо до тех пор, пока в реакторе нет следов влажности; экономически он не может быть жизнеспособным, если нет достаточного количества дешевого сухого хлора, и при этом процессе за одну операцию одновременно получаются два компонента жести. С одной стороны, хлористый станник имеет большое значение для применения при окрашивании текстильных волокон — шелка и т.д. — а с другой стороны, сталь или мягкое железо прекрасно де-золотистые с менее чем 0,1% Sn. По сравнению с другими методами регенерации, процесс сухого хлорного размола имеет только преимущества:
— Первый и второй представленные процессы устарели, имеют неопределенные результаты, требуют дорогостоящих установок, а стоимость восстановленного олова компенсируется только в особых условиях страны.
— При электролизе кислым электролитом потребляется слишком много энергии, так как 50-35% от общего количества поставляемого на сегодняшний день расходуется на работу по растворению железа и производству водорода; установки дорогие, очень подвержены постоянным и серьезным отказам, как и все, кто работает с кислыми жидкостями, так что экономический выход не блестящий, а олово слишком дорогое, чтобы его можно было вывести на рынок.
— Электролиз основного электролита имеет некоторые технические преимущества по сравнению с электролитом кислоты; однако, его высокое потребление энергии — 3.000 кВт/ч/тм — восстановленного олова не выдерживает обработки по цене, по которой выставлен счет за кВт/ч, и потому, что он требует слишком сложной установки, как это бывает сегодня, было бы звуковым чудом, что он мог бы дать экономическую отдачу.
— Облучение сухим хлором на обрезках жести элегантно и просто решает проблему; для этого требуется небольшая установочная сила, мало персонала, небольшая денежная иммобилизация, а побочный продукт может быть без проблем продан на металлургические предприятия после простой мойки.
Жидкий хлор можно найти без особых затруднений — его производит Solvay y Cia. — Самой сложной проблемой является создание конгруэнтной и хорошо функционирующей линии для сбора жести.
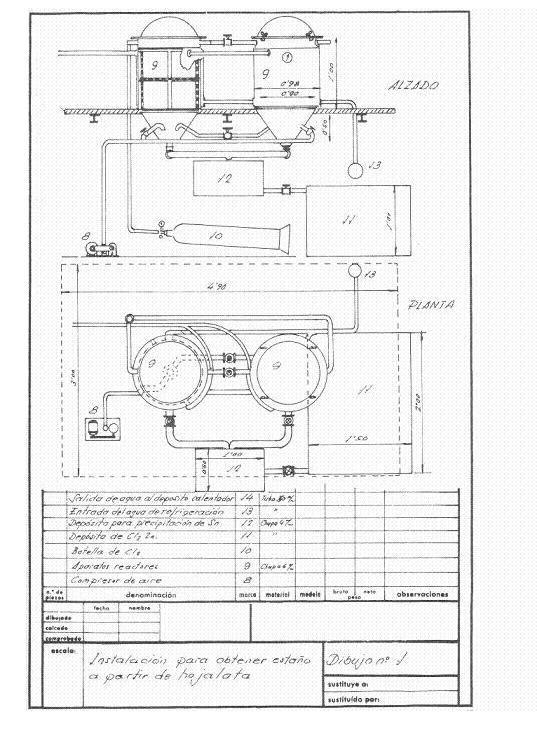
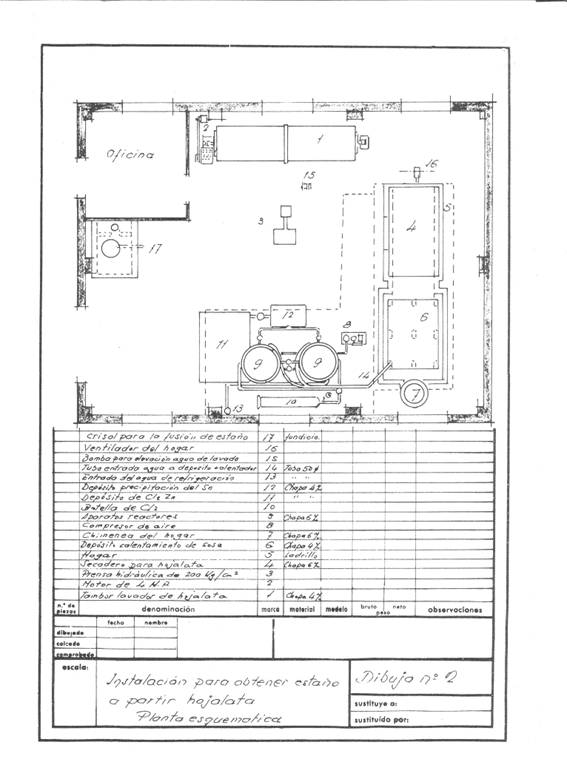
Рисунки 1 и 2 дают представление о проецируемой установке; предполагалось, что она будет иметь частоту восстановления 4 тонны обрезков в день, работая в одну смену, и предполагалось работать в походах.
Рисунок № 1: Пример 1 установки лужения
Рисунок № 2: Пример 2-й установки лужения
При получении отбросов на заводе первой операцией была промывка их примерно 2 кубическими метрами раствора 11-12 Be плотности карбоната натрия, который весит 2160 кг и содержит 1250 кг кристаллической соды — чистота 98%, обработка которой заключается в омывании жировых отбросов, которые могут содержать отбросы, и удалении красок и лаков.
Омыление — это химическая реакция между жирной кислотой (или омыляемым липидом, несущим остатки жирной кислоты) и основанием или щелочью, в которой основным получаемым продуктом является соль этой кислоты и этого основания. Особенность этих соединений в том, что они амфипатичны, то есть имеют полярную и аполярную (или неполярную) частицы, что означает, что они могут взаимодействовать с веществами с различными свойствами. Например, мыло — это соли жирных кислот и щелочных металлов, получаемые в результате этого процесса. Метод омыления в промышленном аспекте заключается в кипячении жира в больших чайниках, медленном добавлении каустической соды (NaOH), непрерывном перемешивании смеси до тех пор, пока она не начнет становиться пастообразной.
Эта операция выполняется во вращающемся барабане емкостью около 3,14 куб. м и использует моечную поверхность площадью около 14,13 м2, построенную из чугунного листа толщиной 4 мм и приводимую в действие двигателем мощностью 4 л.с..
По окончании промывки щелочной раствор декантировали вместе с мылом в резервуаре объемом около 3 м3, расположенном над сушильной печью жести, чтобы сохранить ее горячей и иметь возможность использовать ее снова в новых обработках до тех пор, пока она не будет исчерпана.
Отводы, не содержащие жира, лака и чернил, ополаскиваются горячей водой, которая щедро поступает из охлаждающих реакторов дезактивации.
Чистые обрезки прессуются в призматических пакетах размером 400 x 170 x 200 мм, легко управляемые, так как они весят около 50 кг, в гидравлическом прессе со скоростью около 200 кг/см2.
Эти упаковки высушиваются под атмосферным давлением при температуре около 200º C в течение двух часов со средним потреблением 150 кг угля при 7000 Ккал/кг. Сушильная камера представляла собой своеобразную сушилку полок — без особой сущности — построенную из «фортуны», где средний вентилятор впрыскивал горячий воздух для протаскивания воды через дымовую трубу: все было удобно изолировано слоем магнезии 85%, толщиной 60 мм и весом 280 кг, а перед отправкой в атмосферу было сделано, чтобы отказаться от лишних калорий для подогрева технологических растворов, дымовая труба диаметром 500 мм едва выступала из крыши.
Реакторы были двумя последовательными, и в них можно было продувать сухим воздухом, что позволяло перекачивать оставшийся хлор из готового реактора в другой, так что во время размолаживания один из них извлекал хлористый станник и восстановленную сталь.
В начале дня оба реактора были загружены прессованными и высушенными оловянными пакетами. В первом случае сухой хлор оставляли при 2 атм. Когда давление снижается и охлаждающая вода течет, газ хлора расширяется на свободной поверхности реактора и действует на олово в жести; это непрерывно поглощает хлор до тех пор, пока олово не вступит в реакцию, и когда все олово превращается в стандартный хлорид, давление остается постоянным, и атака прекращается. Через подходящий промежуток времени аппарат продувают сухим воздухом, чтобы унести избыток хлора в законсервированный реактор, который после закрытия начинает работать, в то время как из готового реактора через дно выдувается весь образовавшийся станник хлорида, а когда он больше не капает, вынимают массу облуженной стали, хорошо промывают горячим раствором карбоната натрия, затем промывают горячей водой реактора и получают очень выгодный для сталелитейных заводов остаток низкоуглеродистой стали. Работая таким образом, мы восстановили 251 кг стандартного хлорида и израсходовали 230-240 кг хлора.
Эта цифра восстановленного стандартного хлорида представляет собой извлечение 115 кг металлического олова, т.е. выход извлечения 96%, так что остаток чугуна содержит всего 0,10-0,13% олова, что позволяет без проблем отправлять его на металлургические комбинаты.
Так как реакция растворения очень экзотермична, охлаждение должно тщательно контролироваться для достижения хорошего выхода: в противном случае существует определенный риск сгорания банки.
Жидкий хлор выпускается в стальных баллонах, аналогичных баллонам с кислородом, ацетиленом, углекислым газом и т.д.; они содержат 50 кг чистого веса при 6 атм, и каждый килограмм жидкого хлора поставляет 334 литра сухого газа хлора.
В течение рабочего времени мы использовали 5 бутылок в день для выщелачивания 4 Тм шлама; мы позволили жидкому хлору увеличиться с 6 до 2 атм, для чего мы использовали коммерческий регулятор давления.
Поскольку в то время металл олова был в дефиците, мы также разработали процесс восстановления хлористого олова. Для этого мы подумали о том, чтобы начать электролитическое сокращение без затрат тока и с минимальной установкой; это кажется противоречием, но после соответствующих испытаний, идея не была необоснованной, мы только должны были разработать использование существующей разницы в напряжении между цинком и оловом. Изучая проблему, мы пришли к уверенности: увидели, что цинковый лист, введенный в раствор станничного хлорида, слегка подкисленный соляной кислотой (pH=5-6), выполнил следующие работы:
Cl4Sn + 2 Zn = 2 Cl2Zn + Sn
Cl4Sn + Sn = 2 Cl2Zn
2 Cl2Sn + 2 Zn = 2 Cl2Zn + 2 Sn
Это приводит к тому, что весь цинк растворяется и все олово выпадает в губчатую форму металлического характера, которая собирается, промывается и переплавляется для получения слитка.
Согласно письменным реакциям, 65 кг цинка необходимо для восстановления всего олова из образовавшегося хлорида станника. Мы использовали цинковые листы толщиной 1 мм, которые имеют вес на квадратный метр 6,9 кг, и поэтому нам ежедневно требовалось около 9,5 квадратных метров цинкового листа.
Мы сделали для него «удачную» инсталляцию. Мы построили контейнер размером 1000 x 600 x 500 мм и поместили в него цинковые листы, подвешенные на деревянных рамах. По окончании осадков мы взяли жестяную губку с деревянными лопастями, удалили их и хорошо промыли горячей водой и легко расплавили в железном тигле при температуре 231,5ºС с расходом угля 6-7 % от 7000 ккал/кг гранул.
После расплавления жидкость удалялась с помощью зеленых ветвей дерева для раскисления; шлак удалялся, а очищенная жидкость вводилась в формы для слитков, таким образом, получался металл с чистотой 99,3 — 99,7%, пригодный для сварки и изготовления бронзы и других сплавов.
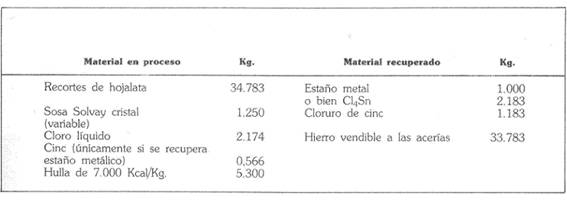
Следующая таблица представляет собой краткий материальный баланс предприятия, установленный для производства одной тонны металла, эквивалентный 2 183 кг стандартного хлорида».















0 Comments