SÍNTESE
Descrição de vários procedimentos industriais para a recuperação de estanho contido em aparas de folha-de-flandres descartadas pela indústria metalúrgica. Deles se deduz que o realmente interessante é aquele que obtém esta lata por um processo seco por lixiviação com cloro.
INTRODUÇÃO
O estanho é o componente mais específico da folha-de-flandres, o que lhe confere a sua principal característica: a sua resistência à corrosão sob a acção de elementos externos. É um metal de alto preço no mercado, pois sua obtenção a partir do minério, além de ser cara, é muito controlada por grandes empresas multinacionais que buscam manter o alto preço e a escassez de oferta diante de uma demanda significativa. Por esta razão, em certos períodos e em certas áreas geográficas, é muitas vezes interessante considerar a recuperação deste metal a partir de aparas de folha-de-flandres descartadas das fábricas de embalagem. Portanto, consideramos interessante reproduzir parcialmente um artigo de Pedro López Gómez publicado sob o título “A RECUPERAÇÃO DO ESTANHO DA PASTA DO PITCHER” na revista “Técnica Industrial”.
“O conteúdo de estanho em folha-de-flandres é variável, variando de 2% em folha espessa a 4,5% em folha fina. Como critério geral, as estacas que não contenham pelo menos 2% de estanho não podem beneficiar economicamente.
O suporte de aço Matin – o núcleo da folha-de-flandres – deve ser extremamente descontinuado para que possa ser reutilizado como sucata. A presença de estanho, mesmo em pequenas quantidades, tem uma influência considerável sobre a ductilidade do aço e um conteúdo de 0,3% de Sn é suficiente para torná-lo frágil e inadequado como aço de recuperação.
Como sabemos, a folha-de-flandres é formada por uma camada externa de estanho quase puro, facilmente separável; por baixo há outra camada cristalina formada por uma verdadeira liga de estanho-ferro que é mais difícil de separar, pois é fortemente aderida à folha de suporte e difícil de atacar.
TRABALHOS PRELIMINARES
Antes de aplicar qualquer método de destinagem é necessário limpar completamente os cortes da folha-de-flandres e remover o máximo possível de gordura, tintas, vernizes e resíduos orgânicos.
Para este fim, as embalagens perfuradas são preparadas e sujeitas a uma espécie de pré-fusão a baixa temperatura para remover o máximo possível de estanho. Antes desta operação, o verniz que cobre os recortes deve ser removido. Para este fim, o verniz é facilmente dissolvido num Solvay alcalino a 10% ou lixívia de soda cáustica; se forem observados resíduos de esmalte, os pacotes de folha-de-flandres são passados através de uma calandra de rolos disposta de forma a que um dos cilindros trabalhe a uma velocidade superior à do outro, fazendo com que o pacote se desprenda e o esmalte se solte.
Há equipamentos no mercado como o “Goldschmidt TH”, que prensa e perfura os cortes com cilindros perfurados, e saponifica as gorduras e vernizes com um tratamento de 3% de lixívia de sódio durante quinze a trinta minutos em autoclave a 110-115º C, depois lava com água quente para eliminar sabões e resíduos de lixívia e depois aquece durante meia hora a 500º C para recuperar a camada externa de estanho, destruindo assim a matéria orgânica – gomas vedantes – e prensa novamente.
Nesta operação ele teve muito cuidado para não formar galo da matéria orgânica, o que mais tarde dificultaria a penetração dos agentes de destinagem.
Os conhecidos processos de de-tinning podem ser classificados em quatro grupos principais:
a) – Processos químicos húmidos.
b) – Processos metalúrgicos secos
c) – Processos eletrolíticos por meio de solução em ácidos ou álcalis.
d) – Processos que utilizam cloro seco
Vamos olhar para cada um deles abaixo.
PROCESSOS QUÍMICOS HÚMIDOS
Durante muito tempo a recuperação do estanho a partir da folha-de-flandres tem sido experimentada utilizando processos químicos de soluções ácidas, álcalis ou soluções salinas, desistindo de continuar a sua utilização por ter baixos rendimentos em cada ocasião.
Kecth e Hette começaram por este caminho com vista a uma electrólise posterior; mas Goldsch-Midt mostrou que quando o estanho é dissolvido por ácidos, o ferro, que é difícil e caro de separar, é dissolvido ao mesmo tempo. Os alcalinos sozinhos ou com a adição de agentes oxidantes não atacam o ferro, mas também não removem completamente a lata, de modo que a chapa de aço também não pode ser utilizada industrialmente.
Schulze trata a folha-de-flandres com solução de cloreto estanoso; dissolve o estanho metálico para o reduzir a sal estanoso:
Cl4Sn + Sn = 2 Cl2Sn
E depois passa o vapor de água, que precipita o oxicloreto de estanoso e regenera o cloreto de estanoso, que retorna ao ciclo:
6 Cl2Sn + 2 H2O + O2 = 4 ClSnOH + 2 Cl4Sn
O ClSnOH separado é filtrado e transformado em óxido estânico SnO2 por oxidação vermelha na presença de ar com liberação de cloro, que é recuperado:
4 SnClOH + 3 O2 = 4 SnO2 + C l2 + 2 H2O
Também foi utilizado cloreto férrico em vez de cloreto estânico como solvente, porque se o Cl3Fe estiver presente em excesso, o estanho é oxidado e o ferro é reduzido:
4 Cl3Fe + Sn = Cl4Sn + 4 Cl2Fe
Quando quase todo o cloreto férrico oxidou o estanho ao cloreto estanhado, este é reduzido com o excesso de estanho presente ao cloreto estanhado.
Cl4Sn + Sn = 2 Cl2Sn
Que com vapor de água é transformado em cloreto estânico básico e pela calcinação subsequente obteremos óxido estânico e recuperaremos o cloro necessário para regenerar o cloreto férrico pela oxidação do Cl2Fe:
2 Cl2Fe + Cl2 = 2 Cl3Fe
Que retorna ao ciclo de lixiviação; em ambos os casos o óxido estânico é reduzido a metal em um forno apropriado.
Reinecken-Ponsgenykopp trata os resíduos de folha de flandres em tambores rotativos com PbO – pulga de óxido – e vapor de água, pelo que consegue – na presença de lixívia de soda previamente adicionada – formar o estanato de sódio SnO3Na2.3H2O e separar o metal de chumbo.
O estanato de sódio pode ser colocado no mercado na forma concentrada ou cristalizada, ou numa operação subsequente a lata pode ser precipitada por meio de um fluxo gasoso de dióxido de carbono e subsequente redução num forno reverberatório.
PROCESSOS METALÚRGICOS SECOS
Este processo é reduzido a uma separação do estanho por fusão e oxidação, parcialmente a “cinzas de estanho”, que são reduzidas em um forno reverberativo ou dissolvidas em metais fundidos, ou para formar sais diretamente ou para usar o metal por simples fusão e separação mecânica das gotas líquidas de estanho.
Por exemplo, o Laroque mistura os resíduos de folha-de-flandres com carvão vegetal – que quase não tem cinzas – e cloreto de sódio, e o Edmunds derrete os resíduos de folha-de-flandres a uma temperatura suficiente para liquefazer o estanho numa centrífuga equipada com um forno especial no seu centro, onde as gotículas de estanho fundido são separadas pela força centrífuga.
Wolterez trata os resíduos de folha-de-flandres em retorta com vapor aquecido a 450-500º C, para separar o estanho do ferro por fusão; nestas condições o estanho não oxida porque está exposto à acção redutora do hidrogénio produzido pela redução do vapor no ferro aquecido; apenas uma ligeira película de óxido pode ser detectada, e não frequentemente, na camada exterior da folha-de-flandres líquida; Também foram experimentados processos que fazem com que o sódio fundido atue sobre o corte da folha-de-flandres; eles têm a vantagem de dissolver completamente a folha-de-flandres, deixando um corte de aço em excelentes condições para que com uma simples forja possa ser usado novamente, mas o processo é complicado, irritante e perigoso, como pode ser deduzido do progresso do processo que estamos descrevendo em linhas gerais: uma série de depósitos estanques e ligados convenientemente com tubos, tudo isto foi construído em aço e funcionou como um escape; à cabeça foram introduzidos os cortes de folha-de-flandres juntamente com liga de sódio ou estanho puro; uma vez fechado hermeticamente, o aparelho foi reaquecido a 400-500º C num forno a gás; o vácuo foi feito e o conteúdo foi agitado, de modo que a folha-de-flandres foi dissolvida em cerca de quinze minutos: Continuando a lixiviação num ciclo contínuo, atinge-se uma liga 50/50; agora só resta recuperar o sódio por destilação para obter o estanho.
PROCESSOS ELECTROLÍTICOS
No início trabalhamos com eletrólito ácido: ácido sulfúrico, sulfato de sódio e cloretos; com este tipo de eletrólito os rendimentos eram baixos e logo foi abandonado. Hoje apenas o eletrólito básico é usado, mas vamos dar uma pequena idéia de como ele era usado no passado.
Gutensonn trabalhou com um electrólito de ácido sulfúrico a 10% aquecido a 60ºC. Ele formou o ânodo com as embalagens de folha-de-flandres colocadas em cestas de madeira de 1200 x 300 x 800 mm. ou seja, com um volume de 0,288 metros cúbicos, enquanto os banhos de aproximadamente um metro cúbico de capacidade foram construídos com madeira de pinho ou faia de 50 mm de espessura, coberta com 3,5 mm de espessura de borracha comprimida. Os cátodos foram formados com chapas de cobre estanhado de 1200 x 0,50 x 1,5 mm; em cada banho havia oito caixas anódicas e 16 caixas catódicas separadas por 100 mm. As características de trabalho foram 240 A, 15 V que teoricamente deveriam separar 4,15 kg de estanho por hora, mas o rendimento prático mal chegou a 45% porque o resto da corrente foi gasta na dissolução do ferro e na libertação de hidrogénio, de modo a obter-se um estanho bastante puro.
No processo alcalino o eletrólito é 10% NaOH, o resto permanece; agora o estanho entra em solução como estanato de sódio da fórmula SnO3Na2, muito solúvel, que se precipita como metal no cátodo.
A precipitação é mais lenta que a dissolução, de modo que o eletrólito é gradualmente enriquecido em estanho, embora com velocidade decrescente.
Um inimigo particular da eficiência atual é a letargia do lixívia de sódio no eletrólito para o dióxido de carbono atmosférico; como carbonatos de NaOH, ele perde atividade de dissolução e condutividade elétrica, o que torna necessário renovar o eletrólito com demasiada freqüência para eliminar o carbonato de sódio formado e as impurezas dissolvidas no ânodo por caustificação; o eletrólito deve ser agitado com freqüência para que o ânodo produza apenas íons estanosos.
A temperatura de trabalho é de cerca de 70º C com uma densidade anódica de 18 A/m2 e 100 A/m2 na região catódica, de modo que se o electrólito contiver 10% de álcalis livres, a eficiência da corrente anódica é de 94-95%. Se a electrólise parar subitamente, os iões estanosos desaparecem e há um aumento imediato da tensão terminal de aproximadamente 0,7-1,2 V.
Agora, com toda a probabilidade, começa a destinagem da liga ferro-lata; a tensão aumenta rapidamente para 1,8 V e apenas 0,08% de estanho permanece na chapa, ou seja, aproximadamente 2,40% da quantidade total a ser recuperada; a eficiência atual é agora de 88-89%, que diminui para 82-83% à medida que a tensão aumenta para 2,5 V e apenas 0,02% de Sn permanece por recuperar, representando 0,05-0,06% da quantidade contida principalmente no clipping.
A diminuição da eficiência elétrica mostra que o trabalho anódico é focado principalmente no ferro; ele se torna passivo e libera oxigênio, o que reduz a eficiência da corrente.
A cor do resíduo anódico não é determinante nem indica o grau de lixiviação do estanho; se com um teor de 0,28% de Sn é cinza azulado e com 0,02% de Sn avermelhado, já com 0,08% mostra eflorescência avermelhada.
Por outro lado, se o eletrólito é total ou parcialmente carbonatado ou se a agitação não é muito vigorosa, o grau de descontinuidade diminui pouco, mas a tensão terminal aumenta e a eficiência da corrente diminui.
A percentagem de estanho no electrólito não deve ser superior a 2,34%; caso contrário a saturação dificulta o ataque anódico e como consequência desagradável pode formar-se ácido metanólico hidratado insolúvel – não recuperável – que se perde na lama anódica.
O processo alcalino é mais rápido e barato que o processo ácido e requer muita vigilância. A vantagem sobre o método do eletrólito ácido é que ele produz um resíduo de aço muito popular nas siderúrgicas, enquanto o resíduo anódico do processo que trabalha com o eletrólito ácido só pode ser usado para obter sulfato ferroso.
O processo ácido tem, por outro lado, a vantagem de o estanho ir para a solução como um íon estanhado, de modo que teoricamente com a mesma quantidade de coulombs o dobro do estanho metálico deve ser separado.
PROCESSO DE LIXIVIAÇÃO DE CLORO SECO
A palavra lixiviação vem do latim: “Lixivia, -ae” substantivo feminino que significa lye. Os romanos usavam este termo para se referir aos sumos destilados das uvas antes de as esmagar, ou às azeitonas antes de as moer. Atualmente, a lixiviação é a lavagem de uma substância pulverizada para extrair as partes solúveis.
Proposta por Higgins e aperfeiçoada por Parmelee, Lambotte Goldsmitd e Weber, varreu industrialmente os outros métodos de extração porque o cloro seco dissolve facilmente o estanho e permite separá-lo na forma de cloreto de estanho sem atacar o aço de suporte; a Alemanha recupera por este processo mais de 85% da produção de aparas.
O Winteler obtém cloreto estânico fazendo trabalhar o cloro seco sobre a folha-de-flandres em cortes a uma temperatura controlada de 40-50º, já que nesta faixa de temperatura o cloro não ataca o ferro; para que isso aconteça é necessário que a temperatura no reator de lixiviação ultrapasse 100º C; se por uma supervisão se forma cloreto férrico, se dirá em termos metalúrgicos que o “estanho foi queimado”; deve-se levar em consideração que a reação:
2Cl2 + Sn = Cl4Sn
Liberta 127,25 Kcal/mol. de cloreto estânico formado, que pode anular o desempenho de lixiviação devido ao aumento de temperatura que ocorre. O ponto crítico está centrado na entrada de cloro no reator; devido à alta densidade específica dos moldes de cloro presentes, ansiosos por reagir, pode se formar uma camada leve de cloreto férrico anidro e cristalino, que devido à sua higroscopicidade absorve a umidade do recinto e a partir deste momento a dissolução do ferro na forma de tricloreto de ferro pode se manifestar com tremenda velocidade em toda a chapa; este problema foi resolvido por Weber J. arrefecendo intensivamente o reactor, melhorando assim o processo e obtendo água quente para a lavagem da lata recuperada.
A técnica de recuperação do estanho a partir da folha-de-flandres baseia-se na propriedade do cloro seco de atacar facilmente o estanho e respeitar o ferro de suporte enquanto não houver vestígios de humidade no reactor; economicamente não pode ser viável se não existirem quantidades suficientes de cloro seco barato e com este processo numa única operação os dois componentes da folha-de-flandres são obtidos ao mesmo tempo. Por um lado, cloreto estânico de grande valor para sua aplicação no tingimento de fibras têxteis – seda, etc. – e, por outro, aço ou ferro suave perfeitamente desengordurado com menos de 0,1% Sn. Em comparação com os outros métodos de recuperação, o processo de destinagem com cloro seco tem apenas vantagens:
– O primeiro e segundo processos apresentados são antiquados, de resultados incertos, requerem instalações caras e o custo da lata recuperada só é compensado em condições especiais de um país.
– Quando se consome demasiada energia com electrólitos ácidos, uma vez que 50-35 % da quantidade total de energia fornecida actualmente é consumida no trabalho de dissolução do ferro e geração de hidrogénio; as instalações são caras, muito expostas a falhas contínuas e graves como todas aquelas que trabalham com líquidos ácidos, de modo que o rendimento económico não é brilhante e a lata é demasiado cara para ser colocada no mercado.
– A eletrólise do eletrólito básico tem algumas vantagens técnicas sobre as do eletrólito ácido; entretanto, seu alto consumo de energia – 3.000 kWh/Tm – de estanho recuperado não sustenta o tratamento ao preço pelo qual o kWh é faturado e porque requer uma instalação muito complexa, como as coisas estão hoje, seria um milagre retumbante que poderia dar retorno econômico.
– A destinagem pela acção do cloro seco sobre os cortes de folha-de-flandres resolve o problema de forma elegante e simples; requer pouca força instalada, pouco pessoal, pouca imobilização monetária e o subproduto pode ser vendido às siderurgias sem qualquer problema após uma simples lavagem.
O cloro líquido pode ser encontrado sem muita dificuldade – é fabricado pela Solvay y Cia. – o problema mais difícil é estabelecer uma linha congruente e funcional para a coleta de recortes de folha-de-flandres.
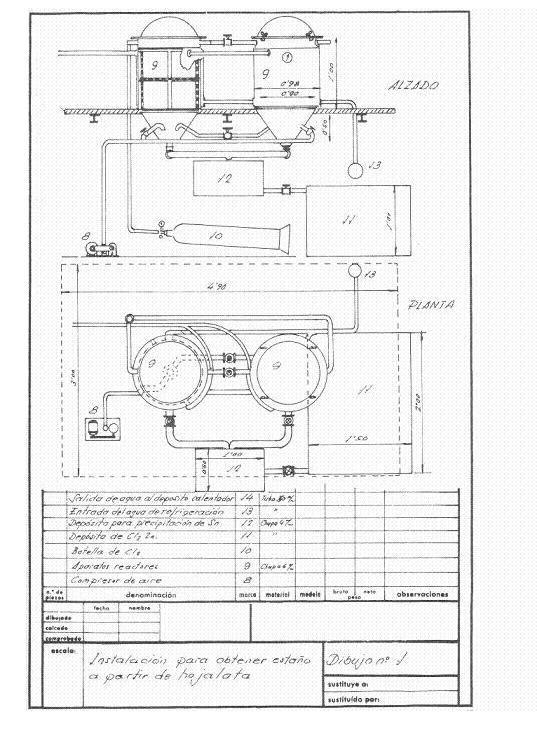
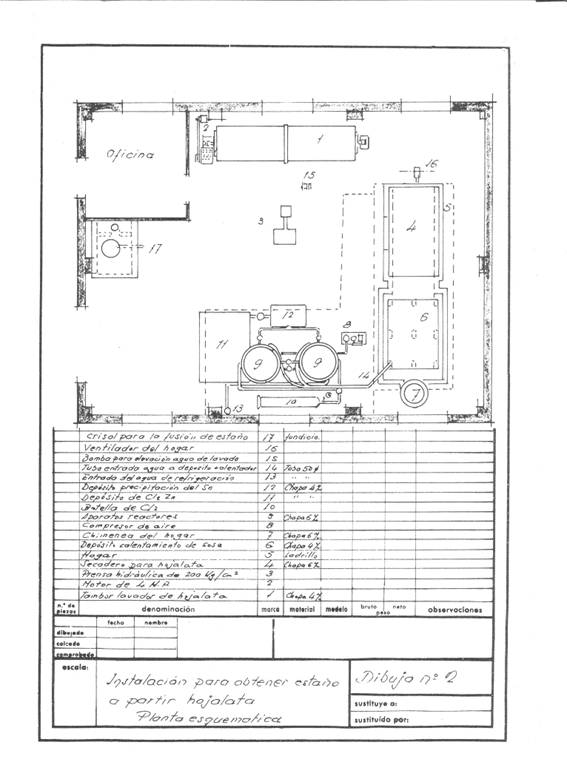
As figuras 1 e 2 dão uma ideia da instalação que foi projectada; pensou-se ter uma frequência de recuperação de 4 toneladas de recortes por dia a trabalhar num turno e pensou-se em trabalhar em campanhas.
Figura nº 1: Exemplo 1 de instalação de destinning
Figura nº 2: Exemplo de segunda instalação de destinning
Quando os restos foram recebidos na fábrica, a primeira operação foi lavá-los com aproximadamente 2 metros cúbicos de uma solução de 11-12 Be densidade de carbonato de sódio, que pesa 2160 kg e contém 1250 kg de soda cristalina – pureza 98% -, tratamento cuja missão é saponificar os resíduos gordos que os restos podem conter e remover tintas e vernizes.
A saponificação é uma reacção química entre um ácido gordo (ou um lípido saponificável, portador de resíduos de ácidos gordos) e uma base ou álcali, em que o principal produto obtido é o sal do ácido e da base. Estes compostos têm a particularidade de serem amphipáticos, ou seja, têm uma parte polar e uma parte apolar (ou não apolar), pelo que podem interagir com substâncias de diferentes propriedades. Por exemplo, os sabões são sais de ácidos gordos e metais alcalinos obtidos por este processo. O método de saponificação no aspecto industrial consiste em ferver a gordura em grandes chaleiras, adicionando lentamente soda cáustica (NaOH), mexendo a mistura continuamente até começar a ficar pastosa.
Esta operação é realizada num tambor rotativo com uma capacidade de cerca de 3,14 metros cúbicos e utiliza uma superfície de lavagem de cerca de 14,13 m2, construído em chapa de ferro de 4 mm de espessura e accionado por um motor de 4 CV.
Uma vez terminada a operação de lavagem, a solução alcalina foi decantada juntamente com os sabões num tanque de cerca de 3 m3 de capacidade, localizado por cima da estufa de secagem da folha-de-flandres para a manter quente e poder voltar a utilizá-la em novos tratamentos até à sua exaustão.
Os cortes sem gordura, varizes e tinta são enxaguados com água quente, que é generosamente obtida a partir do arrefecimento dos reactores de desengorduramento.
As aparas limpas são prensadas em embalagens prismáticas de 400 x 170 x 200 mm, facilmente manejáveis, pois pesam cerca de 50 kg, numa prensa hidráulica a cerca de 200 kg/cm2.
Estas embalagens são secas sob pressão atmosférica a cerca de 200º C durante duas horas, com um consumo médio de 150 kg de carvão a 7000 Kcal/kg. A câmara de secagem era uma espécie de secador de prateleiras – sem muita entidade – construído de “fortuna”, onde um ventilador médio injectava o ar quente para arrastar a água através da chaminé: Tudo era convenientemente isolado com uma camada de magnésia de 85%, 60 mm de espessura e 280 kg de peso, e antes de o enviar para a atmosfera era feito para abrir mão do excesso de calorias para aquecer as soluções de processo, a chaminé de 500 mm de diâmetro mal saltava do telhado.
Os reactores de destinagem eram dois em série, e o ar seco podia ser soprado para dentro deles por conveniência para passar o cloro restante do reactor acabado para o outro, de modo que enquanto um estava a ser destinado, o cloreto estânico e o aço recuperado eram extraídos do outro.
No início do dia, os dois reactores foram carregados com as embalagens de estanho prensado e seco. No primeiro, o cloro seco foi deixado às 2 da manhã. Quando a pressão é reduzida e a água de resfriamento é deixada fluir, o gás cloro se expande na superfície livre do reator e age sobre o estanho na folha de flandres; isto absorve o cloro continuamente enquanto houver estanho não reagido, e quando todo o estanho tiver sido transformado em cloreto de estanho, a pressão permanece constante e o ataque é terminado. Após um intervalo de tempo adequado, o aparelho é soprado com ar seco para levar o excesso de cloro para o reator conservado, que uma vez fechado começa a funcionar, enquanto a partir do reator acabado todo o cloreto estânico formado é soprado através do fundo, e quando já não goteja, a massa de aço destinado é retirada, lavada bem com solução quente de carbonato de sódio, depois enxaguada com a água quente do reator e um resíduo de aço doce muito vantajoso é obtido para a aciaria. Trabalhando desta forma recuperamos 251 kg de cloreto estânico e consumimos 230-240 kg de cloro.
Este valor de cloreto de estanho recuperado representa uma recuperação de 115 kg de estanho metálico, ou seja, um rendimento de recuperação de 96%, de modo que o ferro residual contém apenas 0,10-0,13% de estanho, o que permite que seja enviado para as siderúrgicas sem qualquer problema.
Como a reação de dissolução é muito exotérmica, o resfriamento deve ser cuidadosamente monitorado para se obter um bom rendimento: caso contrário, há um certo risco de queimar a lata.
O cloro líquido está disponível comercialmente em garrafas de aço semelhantes às de oxigénio, acetileno, dióxido de carbono, etc.; contêm 50 kg de peso líquido a 6 atm e cada quilograma de cloro líquido fornece 334 litros de cloro gasoso seco.
Durante o tempo de trabalho usamos 5 garrafas por dia para lixiviar os 4 Tm de aparas; deixamos o cloro líquido expandir de 6 para 2 atm, para o qual usamos um regulador de pressão comercial.
Como o metal de estanho estava em falta naquela época, também desenvolvemos um processo de redução do cloreto de estanho. Para isso pensámos em iniciar uma redução electrolítica sem gastos de corrente e com um mínimo de instalação; parece uma contradição, mas após os testes relevantes, a ideia não foi irrazoável, apenas tivemos de desenvolver uma utilização da diferença de tensão existente entre o zinco e o estanho. Estudando o problema chegamos a uma certeza: vimos que uma folha de zinco introduzida numa solução de cloreto estânico ligeiramente acidificada com ácido clorídrico (pH=5-6), realizou os seguintes trabalhos:
Cl4Sn + 2 Zn = 2 Cl2Zn + Sn
Cl4Sn + Sn = 2 Cl2Zn
2 Cl2Sn + 2 Zn = 2 Cl2Zn + 2 Sn
Isto resulta na consideração de que todo o zinco é dissolvido e todo o estanho precipita-se numa forma esponjosa de carácter metálico, que é recolhido, lavado e refundido para obter o lingote.
Segundo as reacções escritas, 65 kg de zinco são necessários para recuperar todo o estanho do cloreto de estanho formado. Estávamos usando chapas de zinco de 1 mm de espessura que têm um peso por metro quadrado de 6,9 kg e, portanto, precisávamos de cerca de 9,5 metros quadrados de chapas de zinco diariamente.
Fizemos uma instalação de “fortuna” para isso. Construímos um contentor de 1000 x 600 x 500 mm e colocámos nele chapas de zinco suspensas a partir de molduras de madeira. Uma vez terminada a precipitação, pegamos a esponja de estanho com pás de madeira, removemo-las e lavamo-las bem com água quente e fundimo-las num cadinho de ferro facilmente a 231,5º C com um consumo de carvão de 6-7 % de uma pastilha de 7000 Kcal/kg.
Uma vez derretido, o líquido era removido por meio de ramos de madeira verde para desoxidar; a escória era removida e o líquido purificado era introduzido em lingoteiras, obtendo-se assim um metal com uma pureza de 99,3 a 99,7 % adequado à soldadura e à fabricação de bronzes e outras ligas.
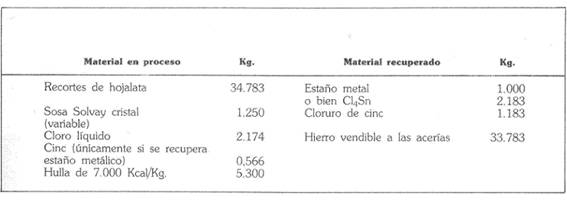
A tabela seguinte é um breve balanço material da operação, estabelecido para uma produção de uma tonelada de metal, equivalente a 2.183 kg de cloreto estânico”.









0 Comments