1. INTRODUÇÃO: A NATUREZA DA CORROSÃO EM EMBALAGENS METÁLICAS
A corrosão é definida tecnicamente como a destruição lenta de um metal pela ação de um agente externo, o que dá lugar a um ataque químico ou físico-químico. Embora os metais geralmente sejam elementos estáveis, a intervenção de agentes externos rompe este equilíbrio. No contexto das embalagens metálicas, fundamentalmente de folha de flandres, este fenômeno é crítico para a integridade do produto e a segurança alimentar.
Todos os metais estão em contato com o ar, composto por 79% de nitrogênio e 21% de oxigênio. Dado que o nitrogênio é um gás inerte, a ação agressiva da atmosfera sobre os metais recai quase exclusivamente no oxigênio. No entanto, para que o processo corrosivo se desencadeie e progrida, o oxigênio requer colaboradores:
- O calor: Que, junto com o oxigênio atmosférico, produz a oxidação superficial.
- A umidade: Que, em combinação com o oxigênio, produz a corrosão propriamente dita.
2. FUNDAMENTOS ELETROQUÍMICOS E O PAR GALVÂNICO
Para compreender a corrosão em embalagens, é imperativo entender o comportamento eletroquímico dos metais. Os metais são classificados em função de seu potencial elétrico:
- Anódicos: Metais com potencial negativo que tendem a ceder elétrons e oxidar-se com facilidade.
- Catódicos: Metais com potencial positivo (como os metais nobres) que atraem íons positivos e são resistentes à corrosão.
Quando dois metais distintos se conectam ou entram em contato na presença de um eletrólito, forma-se um Par Galvânico. Nesta situação, o metal de menor potencial (o mais anódico) é o que se oxida.
2.1. O Caso Específico da Folha de Flandres (Ferro e Estanho)
A folha de flandres apresenta um comportamento dual fascinante dependendo de se a exposição é interna (sem oxigênio) ou externa (com oxigênio).
A) No interior da embalagem (Ausência de oxigênio): O estanho (Sn) atua como ânodo frente ao ferro (Fe).
- Reação: Sn⁰ ⇔ Sn⁺² + 2e⁻ (E₀ = -0,13 V).
- Ferro: Fe⁰ ⇔ Fe⁺² + 2e⁻ (E₀ = -0,44 V).
- O estanho se oxida, protegendo o ferro. Este fenômeno implica uma desestanhagem, mas mantém a integridade estrutural do aço base.
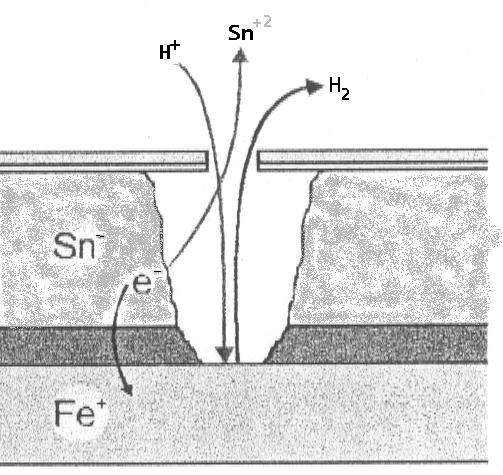
B) No exterior da embalagem (Presença de oxigênio): Ocorre uma inversão de polaridade. O ferro se comporta como ânodo e se oxida frente ao estanho, que atua como cátodo.
- O ferro, ao ser mais eletronegativo neste ambiente, sofre a corrosão.
- Isto dá lugar à formação de óxidos e hidróxidos de ferro (o conhecido “orín” ou ferrugem), cuja cor varia de amarelo a alaranjado dependendo da hidratação.
As reações químicas da oxidação do ferro são: Fe → Fe²⁺ + 2e⁻ (de metal a íon ferroso) Fe²⁺ → Fe³⁺ + e⁻ (de íon ferroso a férrico)
Em presença de umidade ambiental, o produto final é o óxido férrico hidratado de cor laranja-avermelhada: 2 Fe₂O₃ + 6H₂O → 4 Fe(OH)₃
3. CLASSIFICAÇÃO DOS TIPOS DE CORROSÃO
A corrosão pode ser classificada em três grandes categorias segundo o agente externo que a inicia.
3.1. Corrosão Eletroquímica É a mais comum em metais expostos a atmosferas úmidas ou submersos em água. Rege-se pelas séries galvânicas mencionadas anteriormente. Um exemplo clássico é o comportamento do ferro frente ao zinco ou ao estanho:
- Frente ao Zinco (Zn= -0,763 V), o ferro (Fe= -0,440 V) está protegido porque o zinco é mais anódico.
- Frente ao Estanho (Sn= -0,135 V), o ferro é atacado.
A presença de sais, como o cloreto de sódio (NaCl), acelera este processo segundo a reação: 2 ClNa + 2 H₂O ↔ 2 HCl + 2 NaOH O sal reage, mas não se destrói, contribuindo para continuar o processo de corrosão enquanto houver metal e umidade.
3.2. Corrosão Química Produzida pelo ataque direto de ácidos e álcalis.
- Ácidos: O ferro é atacado por ácidos não oxidantes. A presença de enxofre é particularmente perigosa, formando sulfeto de ferro e atuando como catalisador, o que torna arriscado o uso de compostos sulfurantes em embalagens.
- Álcalis: Atacam metais como o alumínio e o estanho. O estanho forma estannitos de sódio solúveis, o que dissolve a camada protetora até a destruição total do revestimento.
3.3. Corrosão Microbiológica É uma das formas menos conhecidas, mas altamente destrutiva. Produz-se pela ação de:
- Bactérias anaeróbicas: Geram metabólitos corrosivos.
- Bactérias aeróbicas: Produzem ácidos minerais corrosivos.
- Fungos: Originam ácidos orgânicos metabólicos.
O metabolismo destes microrganismos gera gases (CO₂, H₂, N₂) e substâncias como amoníaco, água oxigenada e sulfetos, criando um microambiente altamente agressivo para a embalagem.
4. PROPAGAÇÃO E MORFOLOGIA: CORROSÃO LOCALIZADA
Embora exista a corrosão uniforme (que afeta toda a superfície), esta é rara em embalagens revestidas. A forma mais habitual na folha de flandres é a corrosão localizada, que ataca zonas concretas deixando outras intactas, geralmente devido a falhas ou porosidade no revestimento (verniz ou estanho).
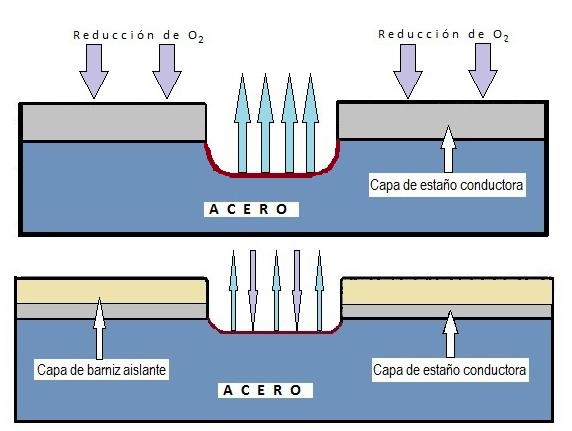
Existem vários tipos de corrosão localizada de especial relevância:
4.1. Corrosão Intergranular Afeta a união dos grãos na estrutura cristalina do metal, debilitando sua resistência mecânica e provocando rupturas irregulares. Não é a mais habitual em embalagens.
4.2. Corrosão por Fendas ou Resquícios (Crevice Corrosion) Ocorre em interstícios ou zonas ocultas onde ficam estancados pequenos volumes de soluções corrosivas (sais ou ácidos). É típica nos fechos das embalagens ou sob as argolas de abertura fácil.
4.3. Corrosão Filiforme Esta é uma variação superficial que acontece sob revestimentos não condutivos (vernizes). Caracteriza-se por formar filamentos estreitos (0,05 a 3 mm de largura) que serpenteiam sob o verniz.
- Mecanismo: Funciona por aeração diferencial. A “cabeça” do filamento é a zona anódica (onde se inicia a corrosão e há acidificação) e a “cauda” é a zona mais arejada.
- Fatores: Requer uma umidade relativa superior a 60% e a presença de sais (cloretos) como iniciadores.
- Prevenção: A qualidade ou quantidade de verniz não evita sua formação; a chave é manter a umidade baixa e evitar resíduos salinos.

4.4. Corrosão por Picadas (Pitting) É a forma mais comum e perigosa de corrosão localizada. Origina-se em imperfeições ou zonas mal arejadas (sob depósitos). Seu perigo reside em que perfura o metal em profundidade, às vezes sendo quase invisível a olho nu desde o exterior. As picadas podem adotar diversas morfologias (estreitas e profundas, elípticas, em galerias, etc.).
4.5. Corrosão por Stress (SCC) Implica uma ruptura frágil do metal devido à combinação de três fatores simultâneos:
- Tensão por tração (stress).
- Um meio corrosivo específico.
- Um metal suscetível.
O processo tem duas etapas: a formação de uma fenda inicial e sua propagação até a fratura do material. É comum observar isto em zonas de embutição profunda ou nos rebites das tampas de fácil abertura.
4.6. Dano por Hidrogênio Causado pela difusão de hidrogênio no metal, frequentemente acelerada por íons sulfurados provenientes da decomposição de proteínas (tioproteínas) no alimento. Reação básica: 2 H⁺ + 2 e⁻ → H₂↑
5. FATORES DO PROCESSO DE FABRICAÇÃO E EMBALAGEM
A corrosão externa não é só um problema de material, mas de processo. Múltiplas etapas influenciam na suscetibilidade da embalagem:
5.1. Danos Mecânicos e Enchimento
- Linhas de alimentação: Os roces e choques danificam o verniz exterior, expondo o aço base.
- Fechamento: É crítico o ajuste das fechadoras. Rulinas mal engraxadas ou mandris não ajustados podem danificar o revestimento na zona do fechamento.
- Enchimento: Restos de produto sobre a embalagem contaminam a água de esterilização, aumentando sua agressividade.
5.2. Esterilização e Resfriamento Durante o tratamento térmico em autoclave:
- Aconselha-se usar separadores entre camadas para evitar roces em quente.
- O ar utilizado para a contrapressão aporta oxigênio corrosivo.
- A introdução direta de vapor pode arrastar condensados alcalinos das caldeiras que atacam o verniz.
- Secagem: É fundamental que a temperatura final da embalagem permita a “autosecagem”. A umidade remanescente na cubeta da tampa ou sob a argola é um caldo de cultura para pilhas galvânicas.
6. QUALIDADE DA ÁGUA: UM FATOR DETERMINANTE
A água de processo (esterilização e resfriamento) pode ser corrosiva ou incrustante. Parâmetros chave a controlar:
- pH: Meios ácidos ou muito alcalinos atacam metal e verniz. Faixa ideal: 6,5 – 8,5.
- Condutividade: Valores altos (< 2000 µS/cm recomendados) favorecem o fluxo de corrente nas pilhas galvânicas.
- Cloretos e Sulfatos: Devem manter-se abaixo de 25 mg/l.
- Resíduo Seco (TDS): Menor a 500 mg/l.
6.1. Índices de Avaliação da Água Para prever o comportamento da água, utilizam-se índices específicos:
A) Índice de Langelier (LSI): Avalia o equilíbrio do carbonato cálcico. Fórmula: LSI = pH – pHs
- Um LSI negativo (< -0,4) indica água corrosiva.
- Um LSI positivo (> 0,2) indica água incrustante (precipitante).
B) Índice de Ryznar (RSI): Fórmula: RSI = 2(pHs) – pH
- Valores >> 7 ou 8 indicam alta corrosividade.
- Valores << 6 indicam tendência a incrustações.
As incrustações (manchas brancas de carbonatos) não são só um problema estético; atuam como zonas de retenção de umidade, favorecendo a corrosão posterior.
6.2. Tratamentos de Passivação Para mitigar a agressividade da água, adicionam-se inibidores catódicos (passivantes) baseados em zinco e ácido fosfórico. Estes criam uma fosfatação superficial sobre o aço que o protege. É vital controlar a dose, pois um excesso aumenta a condutividade e, paradoxalmente, a agressividade da água.
7. ARMAZENAMENTO E TRANSPORTE: CONTROLE AMBIENTAL
Uma vez fabricada e processada, a embalagem segue em risco. A corrosão externa durante o armazenamento e transporte costuma dever-se à condensação e à presença de sais higroscópicos.
7.1. Condições de Armazenagem
- Umidade Relativa (HR): Deve manter-se baixa (por baixo de 60% para evitar corrosão filiforme).
- Temperatura: Evitar mudanças bruscas que levem ao ponto de orvalho e condensação.
- Salinidade: Os depósitos salinos atraem umidade do ambiente (higroscopicidade), iniciando corrosão.
- Materiais de embalagem: O cartão e os separadores não são inertes; devem ser analisados para assegurar que não contenham sais agressivos. O uso de plástico contínuo pode ser contraproducente se retém a umidade interna.


7.2. O Fenômeno da Condensação (Ponto de Orvalho) O risco de condensação depende da relação entre temperatura e umidade relativa. Se a temperatura baixa repentinamente, o excesso de vapor se condensa em água líquida sobre as embalagens frias.
Exemplos críticos de queda de temperatura permitida antes de condensar (para ar inicial a 35ºC):
- A 20% HR: A temperatura deve baixar 28ºC (até 7ºC) para condensar (Risco baixo).
- A 50% HR: Basta que baixe 12ºC (até 23ºC).
- A 75% HR: Com só baixar 5ºC (até 30ºC) produz-se condensação (Risco muito alto).
Isto é crítico no transporte marítimo, onde os contêineres sofrem grandes variações térmicas.
7.3. Proteção contra UV A radiação ultravioleta (solar ou de tubos fluorescentes em exterminadores de insetos) degrada os vernizes e as litografias, debilitando a barreira protetora exterior.
8. MÉTODOS DE PROTEÇÃO E CONCLUSÃO
A luta contra a corrosão baseia-se na prevenção. As estratégias fundamentais incluem:
- Manter a integridade do verniz: Um verniz rompido concentra o ataque anódico.
- Eliminar resíduos higroscópicos: Limpeza exaustiva das embalagens após o fechamento.
- Secagem absoluta: Evitar água em resquícios (fechamentos, argolas).
- Controle ambiental: Armazéns secos, ventilados e com controle de temperatura para evitar o ponto de orvalho.
- Uso de inibidores: Tratamento químico da água de processo (passivação).
Em conclusão, a corrosão em embalagens metálicas é um fenômeno multifatorial que envolve química, metalurgia e física atmosférica, cujo controle depende da gestão integral de todo o ciclo de vida da embalagem.












