1. INTRODUCTION : LA NATURE DE LA CORROSION DANS LES EMBALLAGES MÉTALLIQUES
La corrosion se définit techniquement comme la destruction lente d’un métal par l’action d’un agent extérieur, ce qui entraîne une attaque chimique ou physico-chimique. Bien que les métaux soient généralement des éléments stables, l’intervention d’agents extérieurs rompt cet équilibre. Dans le contexte des emballages métalliques, principalement en fer-blanc, ce phénomène est essentiel pour l’intégrité du produit et la sécurité alimentaire.
Tous les métaux sont en contact avec l’air, composé de 79 % d’azote et de 21 % d’oxygène. Étant donné que l’azote est un gaz inerte, l’action agressive de l’atmosphère sur les métaux incombe presque exclusivement à l’oxygène. Cependant, pour que le processus corrosif se déclenche et progresse, l’oxygène a besoin de collaborateurs :
- La chaleur : Qui, avec l’oxygène atmosphérique, produit l’oxydation superficielle.
- L’humidité : Qui, en combinaison avec l’oxygène, produit la corrosion proprement dite.
2. FONDEMENTS ÉLECTROCHIMIQUES ET LE COUPLE GALVANIQUE
Pour comprendre la corrosion dans les emballages, il est impératif de comprendre le comportement électrochimique des métaux. Les métaux sont classés en fonction de leur potentiel électrique :
- Anodiques : Métaux à potentiel négatif qui ont tendance à céder des électrons et à s’oxyder facilement.
- Cathodiques : Métaux à potentiel positif (comme les métaux nobles) qui attirent les ions positifs et sont résistants à la corrosion.
Lorsque deux métaux différents sont connectés ou entrent en contact en présence d’un électrolyte, un Couple Galvanique se forme. Dans cette situation, le métal au potentiel le plus faible (le plus anodique) est celui qui s’oxyde.
2.1. Le cas spécifique du fer-blanc (fer et étain)
Le fer-blanc présente un comportement dual fascinant selon que l’exposition est interne (sans oxygène) ou externe (avec oxygène).
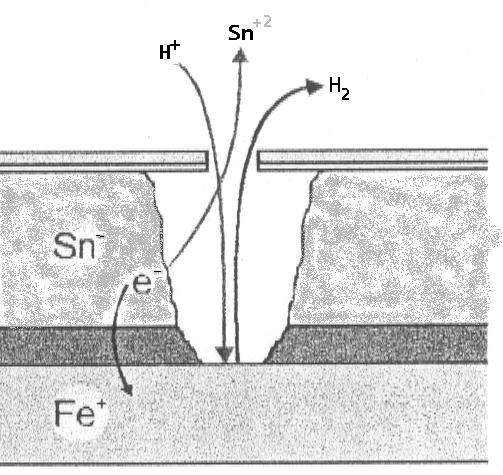
A) À l’intérieur de l’emballage (absence d’oxygène) : L’étain (Sn) agit comme anode par rapport au fer (Fe).
- Réaction : Sn⁰ ⇔ Sn⁺² + 2e⁻ (E₀ = -0,13 V).
- Fer : Fe⁰ ⇔ Fe⁺² + 2e⁻ (E₀ = -0,44 V).
- L’étain s’oxyde, protégeant le fer. Ce phénomène implique un déétamage, mais maintient l’intégrité structurelle de l’acier de base.
B) À l’extérieur de l’emballage (présence d’oxygène) : Une inversion de polarité se produit. Le fer se comporte comme une anode et s’oxyde par rapport à l’étain, qui agit comme une cathode.
- Le fer, étant plus électronégatif dans cet environnement, subit la corrosion.
- Cela entraîne la formation d’oxydes et d’hydroxydes de fer (la « rouille » bien connue), dont la couleur varie du jaune à l’orange selon l’hydratation.
Les réactions chimiques de l’oxydation du fer sont : Fe → Fe²⁺ + 2e⁻ (du métal à l’ion ferreux) Fe²⁺ → Fe³⁺ + e⁻ (de l’ion ferreux à l’ion ferrique)
En présence d’humidité ambiante, le produit final est l’oxyde ferrique hydraté de couleur orange-rougeâtre : 2 Fe₂O₃ + 6H₂O → 4 Fe(OH)₃
3. CLASSIFICATION DES TYPES DE CORROSION
La corrosion peut être classée en trois grandes catégories selon l’agent extérieur qui la déclenche.
3.1. Corrosion électrochimique C’est la plus courante dans les métaux exposés à des atmosphères humides ou immergés dans l’eau. Elle est régie par les séries galvaniques mentionnées précédemment. Un exemple classique est le comportement du fer face au zinc ou à l’étain :
- Face au zinc (Zn= -0,763 V), le fer (Fe= -0,440 V) est protégé car le zinc est plus anodique.
- Face à l’étain (Sn= -0,135 V), le fer est attaqué.
La présence de sels, comme le chlorure de sodium (NaCl), accélère ce processus selon la réaction : 2 ClNa + 2 H₂O ↔ 2 HCl + 2 NaOH Le sel réagit mais n’est pas détruit, contribuant à la poursuite du processus de corrosion tant qu’il y a du métal et de l’humidité.
3.2. Corrosion chimique Produite par l’attaque directe d’acides et d’alcalis.
- Acides : Le fer est attaqué par des acides non oxydants. La présence de soufre est particulièrement dangereuse, formant du sulfure de fer et agissant comme catalyseur, ce qui rend risqué l’utilisation de composés sulfurés dans les emballages.
- Alcalis : Attaquent les métaux comme l’aluminium et l’étain. L’étain forme des stannites de sodium solubles, ce qui dissout la couche protectrice jusqu’à la destruction totale du revêtement.
3.3. Corrosion microbiologique C’est l’une des formes les moins connues mais hautement destructrices. Elle est produite par l’action de :
- Bactéries anaérobies : Génèrent des métabolites corrosifs.
- Bactéries aérobies : Produisent des acides minéraux corrosifs.
- Champignons : Provoquent des acides organiques métaboliques.
Le métabolisme de ces micro-organismes génère des gaz (CO₂, H₂, N₂) et des substances comme l’ammoniac, l’eau oxygénée et les sulfures, créant un micro-environnement hautement agressif pour l’emballage.
4. PROPAGATION ET MORPHOLOGIE : CORROSION LOCALISÉE
Bien qu’il existe une corrosion uniforme (qui affecte toute la surface), elle est rare dans les emballages revêtus. La forme la plus courante dans le fer-blanc est la corrosion localisée, qui attaque des zones spécifiques en laissant d’autres intactes, généralement en raison de défauts ou de porosité dans le revêtement (vernis ou étain).
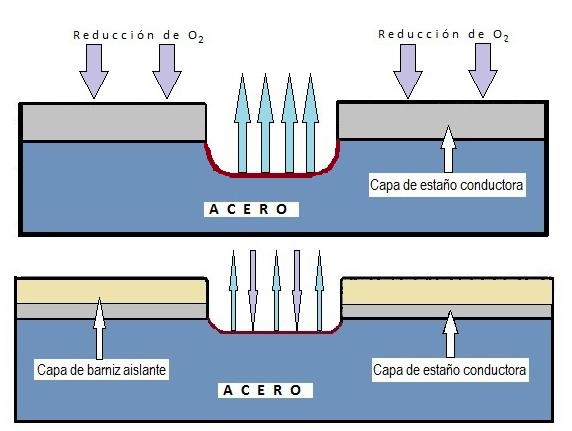
Il existe plusieurs types de corrosion localisée particulièrement importants :
4.1. Corrosion intergranulaire Affecte la liaison des grains dans la structure cristalline du métal, affaiblissant sa résistance mécanique et provoquant des ruptures irrégulières. Ce n’est pas la plus courante dans les emballages.
4.2. Corrosion par piqûres ou crevasses (Crevice Corrosion) Se produit dans les interstices ou les zones cachées où de petits volumes de solutions corrosives (sels ou acides) restent stagnants. Elle est typique des fermetures des emballages ou sous les anneaux d’ouverture facile.
4.3. Corrosion filiforme Il s’agit d’une variation superficielle qui se produit sous des revêtements non conducteurs (vernis). Elle se caractérise par la formation de filaments étroits (0,05 à 3 mm de large) qui serpentent sous le vernis.
- Mécanisme : Fonctionne par aération différentielle. La « tête » du filament est la zone anodique (où la corrosion commence et où il y a acidification) et la « queue » est la zone la plus aérée.
- Facteurs : Nécessite une humidité relative supérieure à 60 % et la présence de sels (chlorures) comme initiateurs.
- Prévention : La qualité ou la quantité de vernis n’empêche pas sa formation ; la clé est de maintenir une faible humidité et d’éviter les résidus salins.

4.4. Corrosion par piqûres (Pitting) C’est la forme la plus courante et la plus dangereuse de corrosion localisée. Elle se produit dans les imperfections ou les zones mal aérées (sous les dépôts). Son danger réside dans le fait qu’elle perfore le métal en profondeur, parfois presque invisible à l’œil nu de l’extérieur. Les piqûres peuvent adopter diverses morphologies (étroites et profondes, elliptiques, en galeries, etc.).
4.5. Corrosion sous contrainte (SCC) Implique une rupture fragile du métal due à la combinaison de trois facteurs simultanés :
- Tension de traction (stress).
- Un milieu corrosif spécifique.
- Un métal susceptible.
Le processus se déroule en deux étapes : la formation d’une fissure initiale et sa propagation jusqu’à la fracture du matériau. Il est courant d’observer cela dans les zones d’emboutissage profond ou dans les rivets des couvercles faciles à ouvrir.
4.6. Dommage causé par l’hydrogène Causé par la diffusion d’hydrogène dans le métal, souvent accélérée par des ions sulfurés provenant de la décomposition des protéines (tioprotéines) dans l’aliment. Réaction de base : 2 H⁺ + 2 e⁻ → H₂↑
5. FACTEURS DU PROCESSUS DE FABRICATION ET D’EMBALLAGE
La corrosion externe n’est pas seulement un problème de matériau, mais de processus. Plusieurs étapes influent sur la susceptibilité de l’emballage :
5.1. Dommages mécaniques et remplissage
- Lignes d’alimentation : Les frottements et les chocs endommagent le vernis extérieur, exposant l’acier de base.
- Fermeture : Le réglage des sertisseuses est essentiel. Des molettes mal graissées ou des mandrins non ajustés peuvent endommager le revêtement dans la zone de fermeture.
- Remplissage : Les restes de produit sur l’emballage contaminent l’eau de stérilisation, augmentant son agressivité.
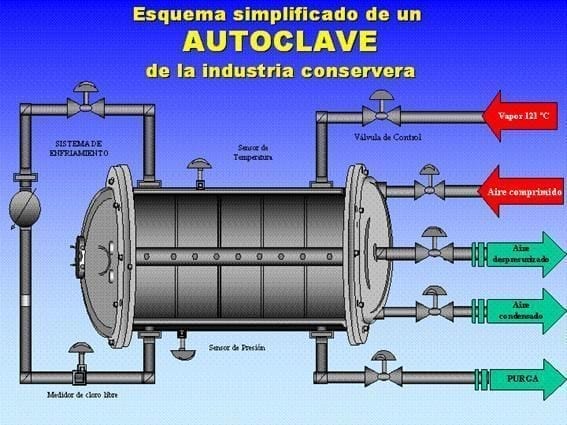
5.2. Stérilisation et refroidissement Pendant le traitement thermique en autoclave :
- Il est conseillé d’utiliser des séparateurs entre les couches pour éviter les frottements à chaud.
- L’air utilisé pour la contre-pression apporte de l’oxygène corrosif.
- L’introduction directe de vapeur peut entraîner des condensats alcalins des chaudières qui attaquent le vernis.
- Séchage : Il est essentiel que la température finale de l’emballage permette l' »autosechage ». L’humidité restante dans la cuvette du couvercle ou sous l’anneau est un terrain fertile pour les piles galvaniques.
6. QUALITÉ DE L’EAU : UN FACTEUR DÉTERMINANT
L’eau de process (stérilisation et refroidissement) peut être corrosive ou incrustante. Paramètres clés à contrôler :
- pH : Les milieux acides ou très alcalins attaquent le métal et le vernis. Plage idéale : 6,5 – 8,5.
- Conductivité : Des valeurs élevées (< 2000 µS/cm recommandées) favorisent le flux de courant dans les piles galvaniques.
- Chlorures et sulfates : Doivent être maintenus en dessous de 25 mg/l.
- Résidu sec (TDS) : Inférieur à 500 mg/l.
6.1. Indices d’évaluation de l’eau Pour prédire le comportement de l’eau, des indices spécifiques sont utilisés :
A) Indice de Langelier (LSI) : Évalue l’équilibre du carbonate de calcium. Formule : LSI = pH – pHs
- Un LSI négatif (< -0,4) indique une eau corrosive.
- Un LSI positif (> 0,2) indique une eau incrustante (précipitante).
B) Indice de Ryznar (RSI) : Formule : RSI = 2(pHs) – pH
- Des valeurs >> 7 ou 8 indiquent une forte corrosivité.
- Des valeurs << 6 indiquent une tendance à l’encrassement.
Les incrustations (taches blanches de carbonates) ne sont pas seulement un problème esthétique ; elles agissent comme des zones de rétention d’humidité, favorisant la corrosion ultérieure.
6.2. Traitements de passivation Pour atténuer l’agressivité de l’eau, des inhibiteurs cathodiques (passivants) à base de zinc et d’acide phosphorique sont ajoutés. Ceux-ci créent une phosphatation superficielle sur l’acier qui le protège. Il est essentiel de contrôler la dose, car un excès augmente la conductivité et, paradoxalement, l’agressivité de l’eau.
7. STOCKAGE ET TRANSPORT : CONTRÔLE ENVIRONNEMENTAL
Une fois fabriqué et traité, l’emballage reste à risque. La corrosion externe pendant le stockage et le transport est généralement due à la condensation et à la présence de sels hygroscopiques.
7.1. Conditions de stockage
- Humidité relative (HR) : Doit être maintenue basse (en dessous de 60 % pour éviter la corrosion filiforme).
- Température : Éviter les changements brusques qui mènent au point de rosée et à la condensation.
- Salinité : Les dépôts salins attirent l’humidité de l’environnement (hygroscopicité), initiant la corrosion.
- Matériaux d’emballage : Le carton et les séparateurs ne sont pas inertes ; ils doivent être analysés pour s’assurer qu’ils ne contiennent pas de sels agressifs. L’utilisation de plastique continu peut être contre-productive s’il retient l’humidité interne.


7.2. Le phénomène de la condensation (point de rosée) Le risque de condensation dépend de la relation entre la température et l’humidité relative. Si la température baisse soudainement, l’excès de vapeur se condense en eau liquide sur les emballages froids.
Exemples critiques de chute de température autorisée avant condensation (pour l’air initial à 35 ºC) :
- À 20 % HR : La température doit baisser de 28 ºC (jusqu’à 7 ºC) pour condenser (risque faible).
- À 50 % HR : Il suffit qu’elle baisse de 12 ºC (jusqu’à 23 ºC).
- À 75 % HR : Avec une baisse de seulement 5 ºC (jusqu’à 30 ºC), la condensation se produit (risque très élevé).
Ceci est essentiel dans le transport maritime, où les conteneurs subissent de grandes variations thermiques.
7.3. Protection contre les UV Le rayonnement ultraviolet (solaire ou des tubes fluorescents dans les destructeurs d’insectes) dégrade les vernis et les lithographies, affaiblissant la barrière protectrice extérieure.
8. MÉTHODES DE PROTECTION ET CONCLUSION
La lutte contre la corrosion repose sur la prévention. Les stratégies fondamentales comprennent :
- Maintenir l’intégrité du vernis : Un vernis cassé concentre l’attaque anodique.
- Éliminer les résidus hygroscopiques : Nettoyage approfondi des emballages après la fermeture.
- Séchage absolu : Éviter l’eau dans les crevasses (fermetures, anneaux).
- Contrôle environnemental : Entrepôts secs, ventilés et avec contrôle de la température pour éviter le point de rosée.
- Utilisation d’inhibiteurs : Traitement chimique de l’eau de process (passivation).
En conclusion, la corrosion dans les emballages métalliques est un phénomène multifactoriel qui implique la chimie, la métallurgie et la physique atmosphérique, dont le contrôle dépend de la gestion intégrale de tout le cycle de vie de l’emballage.