1. مقدمة: طبيعة التآكل في العبوات المعدنية
يُعرَّف التآكل تقنيًا بأنه التدمير البطيء للمعدن بفعل عامل خارجي، مما يؤدي إلى هجوم كيميائي أو فيزيائي-كيميائي. على الرغم من أن المعادن عادة ما تكون عناصر مستقرة، إلا أن تدخل العوامل الخارجية يكسر هذا التوازن. في سياق العبوات المعدنية، وخاصة الصفيح، تعتبر هذه الظاهرة حاسمة لسلامة المنتج وسلامة الأغذية.
تتلامس جميع المعادن مع الهواء، الذي يتكون من 79٪ نيتروجين و 21٪ أكسجين. نظرًا لأن النيتروجين غاز خامل، فإن التأثير العدواني للغلاف الجوي على المعادن يقع بشكل حصري تقريبًا على الأكسجين. ومع ذلك، لكي تبدأ عملية التآكل وتتقدم، يتطلب الأكسجين متعاونين:
- الحرارة: التي تنتج الأكسدة السطحية جنبًا إلى جنب مع الأكسجين في الغلاف الجوي.
- الرطوبة: التي تنتج التآكل الفعلي بالاشتراك مع الأكسجين.
2. الأسس الكهروكيميائية والزوج الجلفاني
لفهم التآكل في العبوات، من الضروري فهم السلوك الكهروكيميائي للمعادن. تصنف المعادن بناءً على جهدها الكهربائي:
- أنودية: معادن ذات جهد سلبي تميل إلى التخلي عن الإلكترونات والأكسدة بسهولة.
- كاثودية: معادن ذات جهد موجب (مثل المعادن النبيلة) تجذب الأيونات الموجبة ومقاومة للتآكل.
عندما يتصل معدنان مختلفان أو يتلامسان في وجود إلكتروليت، يتشكل زوج جلفاني. في هذه الحالة، يتأكسد المعدن ذو الجهد الأقل (الأكثر أنودية).
2.1. الحالة الخاصة للصفيح (الحديد والقصدير)
يُظهر الصفيح سلوكًا مزدوجًا رائعًا اعتمادًا على ما إذا كان التعرض داخليًا (بدون أكسجين) أو خارجيًا (مع الأكسجين).
أ) داخل العبوة (غياب الأكسجين): يعمل القصدير (Sn) كأنود مقابل الحديد (Fe).
- التفاعل: Sn⁰ ⇔ Sn⁺² + 2e⁻ (E₀ = -0.13 V).
- الحديد: Fe⁰ ⇔ Fe⁺² + 2e⁻ (E₀ = -0.44 V).
- يتأكسد القصدير، مما يحمي الحديد. تنطوي هذه الظاهرة على إزالة القصدير، ولكنها تحافظ على السلامة الهيكلية للفولاذ الأساسي.
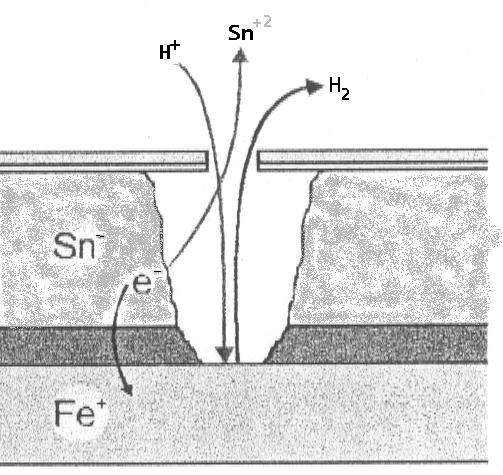
ب) في الجزء الخارجي من العبوة (وجود الأكسجين): يحدث انعكاس في القطبية. يتصرف الحديد كأنود ويتأكسد مقابل القصدير، الذي يعمل ككاثود.
- يعاني الحديد من التآكل لكونه أكثر سالبية كهربائية في هذه البيئة.
- يؤدي هذا إلى تكوين أكاسيد وهيدروكسيدات الحديد (المعروف باسم “الصدأ”), الذي يختلف لونه من الأصفر إلى البرتقالي اعتمادًا على الترطيب.
التفاعلات الكيميائية لأكسدة الحديد هي: Fe → Fe²⁺ + 2e⁻ (من المعدن إلى أيون الحديدوز) Fe²⁺ → Fe³⁺ + e⁻ (من أيون الحديدوز إلى الحديديك)
في وجود الرطوبة البيئية، يكون المنتج النهائي هو أكسيد الحديديك المائي ذو اللون البرتقالي المحمر: 2 Fe₂O₃ + 6H₂O → 4 Fe(OH)₃
3. تصنيف أنواع التآكل
يمكن تصنيف التآكل إلى ثلاث فئات رئيسية حسب العامل الخارجي الذي يبدأه.
3.1. التآكل الكهروكيميائي هو الأكثر شيوعًا في المعادن المعرضة للأجواء الرطبة أو المغمورة في الماء. تحكمه السلاسل الجلفانية المذكورة أعلاه. مثال كلاسيكي هو سلوك الحديد مقابل الزنك أو القصدير:
- أمام الزنك (Zn= -0.763 V)، يكون الحديد (Fe= -0.440 V) محميًا لأن الزنك أكثر أنودية.
- أمام القصدير (Sn= -0.135 V)، يتعرض الحديد للهجوم.
وجود الأملاح، مثل كلوريد الصوديوم (NaCl)، يسرع هذه العملية وفقًا للتفاعل: 2 ClNa + 2 H₂O ↔ 2 HCl + 2 NaOH يتفاعل الملح ولكنه لا يتلف، مما يساهم في استمرار عملية التآكل طالما كان هناك معدن ورطوبة.
3.2. التآكل الكيميائي ينتج عن طريق الهجوم المباشر للأحماض والقلويات.
- الأحماض: يهاجم الحديد بواسطة أحماض غير مؤكسدة. وجود الكبريت خطير بشكل خاص، حيث يشكل كبريتيد الحديد ويعمل كمحفز، مما يجعل استخدام المركبات المحتوية على الكبريت في العبوات أمرًا محفوفًا بالمخاطر.
- القلويات: تهاجم معادن مثل الألومنيوم والقصدير. يشكل القصدير ستانيتات الصوديوم القابلة للذوبان، مما يذيب الطبقة الواقية حتى التدمير الكامل للطلاء.
3.3. التآكل الميكروبيولوجي هو أحد الأشكال الأقل شهرة ولكنه مدمر للغاية. ينتج عن طريق عمل:
- البكتيريا اللاهوائية: تولد مستقلبات أكالة.
- البكتيريا الهوائية: تنتج أحماض معدنية أكالة.
- الفطريات: تنشأ أحماض عضوية أيضية.
ينتج عن استقلاب هذه الكائنات الحية الدقيقة غازات (CO₂، H₂، N₂) ومواد مثل الأمونيا وبيروكسيد الهيدروجين والكبريتيدات، مما يخلق بيئة دقيقة شديدة العدوانية للعبوة.
4. الانتشار والمورفولوجيا: التآكل الموضعي
على الرغم من وجود تآكل منتظم (يؤثر على السطح بأكمله)، إلا أنه نادر في العبوات المطلية. الشكل الأكثر شيوعًا في الصفيح هو التآكل الموضعي، الذي يهاجم مناطق معينة ويترك مناطق أخرى سليمة، ويرجع ذلك عمومًا إلى عيوب أو مسامية في الطلاء (الورنيش أو القصدير).
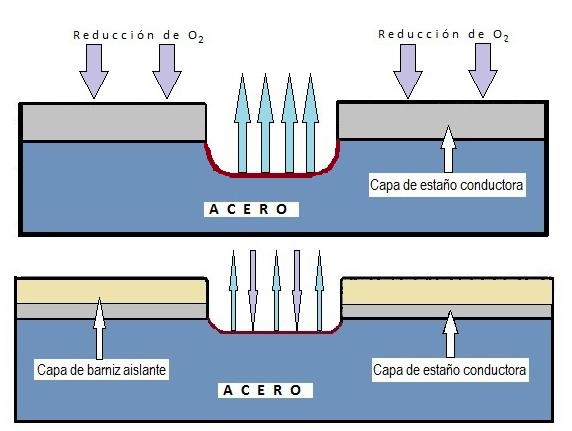
توجد عدة أنواع من التآكل الموضعي ذات أهمية خاصة:
4.1. التآكل بين الحبيبات يؤثر على اتحاد الحبوب في البنية البلورية للمعدن، مما يضعف مقاومته الميكانيكية ويسبب كسورًا غير منتظمة. ليس هو الأكثر شيوعًا في العبوات.
4.2. التآكل الناتج عن الشقوق أو الفتحات (تآكل الشقوق) يحدث في الفراغات أو المناطق المخفية حيث تتراكم كميات صغيرة من المحاليل المسببة للتآكل (الأملاح أو الأحماض). إنه نموذجي في أغطية العبوات أو أسفل حلقات الفتح السهل.
4.3. التآكل الخيطي هذا هو شكل سطحي يحدث تحت الطلاءات غير الموصلة (الورنيش). يتميز بتكوين خيوط ضيقة (من 0.05 إلى 3 مم عرضًا) تلتوي تحت الورنيش.
- الآلية: يعمل عن طريق التهوية التفاضلية. “رأس” الخيط هو المنطقة الأنودية (حيث يبدأ التآكل ويحدث التحمض) و “الذيل” هو المنطقة الأكثر تهوية.
- العوامل: يتطلب رطوبة نسبية تزيد عن 60٪ ووجود أملاح (كلوريدات) كمبادرات.
- الوقاية: لا تمنع الجودة أو كمية الورنيش تكوينه؛ المفتاح هو الحفاظ على الرطوبة منخفضة وتجنب المخلفات الملحية.

4.4. التآكل التنقري هو الشكل الأكثر شيوعًا وخطورة للتآكل الموضعي. ينشأ في العيوب أو المناطق سيئة التهوية (تحت الرواسب). يكمن خطره في أنه يثقب المعدن في العمق، وأحيانًا يكون غير مرئي تقريبًا بالعين المجردة من الخارج. يمكن أن تتخذ النقرات أشكالًا مختلفة (ضيقة وعميقة، بيضاوية، في صالات العرض، إلخ).
4.5. التآكل الناتج عن الإجهاد (SCC) ينطوي على كسر هش للمعدن بسبب الجمع بين ثلاثة عوامل متزامنة:
- إجهاد الشد (الإجهاد).
- وسط أكالة محدد.
- معدن قابل للتأثر.
تتكون العملية من مرحلتين: تكوين صدع أولي وانتشاره حتى كسر المادة. من الشائع ملاحظة ذلك في مناطق السحب العميق أو في مسامير التثبيت للأغطية سهلة الفتح.
4.6. تلف الهيدروجين ناجم عن انتشار الهيدروجين في المعدن، وغالبًا ما يتم تسريعه بواسطة أيونات الكبريتيد القادمة من تحلل البروتينات (البروتينات الثيوية) في الطعام. التفاعل الأساسي: 2 H⁺ + 2 e⁻ → H₂↑
5. عوامل عملية التصنيع والتعبئة
التآكل الخارجي ليس مجرد مشكلة مادية، ولكنه مشكلة عملية. تؤثر مراحل متعددة على قابلية العبوة للتأثر:
5.1. الأضرار الميكانيكية والتعبئة
- خطوط التغذية: تتسبب الاحتكاكات والصدمات في تلف الورنيش الخارجي، مما يعرض الفولاذ الأساسي.
- الإغلاق: يعد ضبط آلات الإغلاق أمرًا بالغ الأهمية. يمكن أن تتسبب البكرات سيئة التشحيم أو المغازل غير المضبوطة في تلف الطلاء في منطقة الإغلاق.
- التعبئة: تتسبب بقايا المنتج على العبوة في تلوث مياه التعقيم، مما يزيد من عدوانيتها.
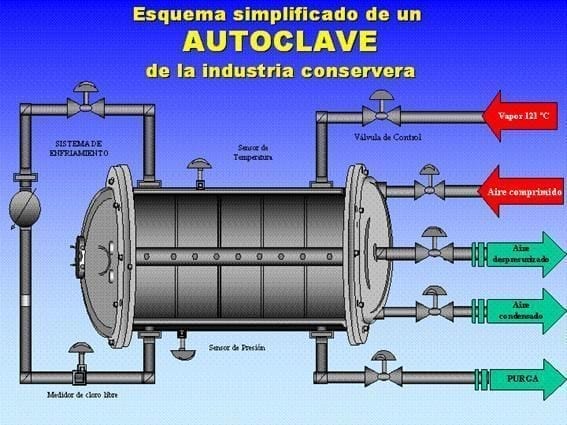
5.2. التعقيم والتبريد أثناء المعالجة الحرارية في الأوتوكلاف:
- ينصح باستخدام فواصل بين الطبقات لتجنب الاحتكاك الساخن.
- يوفر الهواء المستخدم للضغط المعاكس أكسجينًا أكالًا.
- قد يؤدي الإدخال المباشر للبخار إلى سحب المكثفات القلوية من الغلايات التي تهاجم الورنيش.
- التجفيف: من الضروري أن تسمح درجة الحرارة النهائية للعبوة بـ “التجفيف الذاتي”. الرطوبة المتبقية في حوض الغطاء أو أسفل الحلقة هي أرض خصبة للخلايا الجلفانية.
6. جودة المياه: عامل حاسم
يمكن أن تكون مياه المعالجة (التعقيم والتبريد) أكالة أو متسببة في تكون القشور. المعلمات الرئيسية التي يجب التحكم فيها:
- الرقم الهيدروجيني: تهاجم الأوساط الحمضية أو القلوية للغاية المعدن والورنيش. النطاق المثالي: 6.5 – 8.5.
- التوصيلية: القيم العالية (يوصى بـ < 2000 ميكرو ثانية/سم) تعزز تدفق التيار في الخلايا الجلفانية.
- الكلوريدات والكبريتات: يجب أن تبقى أقل من 25 ملجم/لتر.
- المخلفات الجافة (TDS): أقل من 500 ملجم/لتر.
6.1. مؤشرات تقييم المياه للتنبؤ بسلوك الماء، يتم استخدام مؤشرات محددة:
أ) مؤشر لانجلير (LSI): يقيم توازن كربونات الكالسيوم. الصيغة: LSI = pH – pHs
- يشير LSI سلبي (< -0.4) إلى مياه أكالة.
- يشير LSI إيجابي (> 0.2) إلى مياه متسببة في تكون القشور (مترسبة).
ب) مؤشر ريزنار (RSI): الصيغة: RSI = 2(pHs) – pH
- تشير القيم >> 7 أو 8 إلى قابلية عالية للتآكل.
- تشير القيم << 6 إلى ميل لتكون القشور.
القشور (بقع بيضاء من الكربونات) ليست مجرد مشكلة جمالية؛ إنها تعمل كمناطق احتجاز للرطوبة، مما يعزز التآكل اللاحق.
6.2. معالجات التخميل للتخفيف من عدوانية الماء، تضاف مثبطات كاثودية (تخميل) تعتمد على الزنك وحمض الفوسفوريك. تخلق هذه المثبطات فوسفات سطحي على الفولاذ يحميه. من الضروري التحكم في الجرعة، لأن الزيادة تزيد من التوصيلية، وعلى نحو مفارق، من عدوانية الماء.
7. التخزين والنقل: التحكم البيئي
بمجرد تصنيع العبوة ومعالجتها، فإنها تظل معرضة للخطر. عادة ما يكون التآكل الخارجي أثناء التخزين والنقل بسبب التكثيف ووجود الأملاح المسترطبة.
7.1. ظروف المستودع
- الرطوبة النسبية (HR): يجب أن تظل منخفضة (أقل من 60٪ لتجنب التآكل الخيطي).
- درجة الحرارة: تجنب التغيرات المفاجئة التي تؤدي إلى نقطة الندى والتكثيف.
- الملوحة: تجذب الرواسب الملحية الرطوبة من البيئة (الاسترطابية)، مما يبدأ التآكل.
- مواد التعبئة والتغليف: الكرتون والفواصل ليست خاملة؛ يجب تحليلها للتأكد من أنها لا تحتوي على أملاح أكالة. قد يكون استخدام البلاستيك المستمر ضارًا إذا كان يحتفظ بالرطوبة الداخلية.


7.2. ظاهرة التكثيف (نقطة الندى) يعتمد خطر التكثيف على العلاقة بين درجة الحرارة والرطوبة النسبية. إذا انخفضت درجة الحرارة فجأة، يتكثف البخار الزائد في ماء سائل على العبوات الباردة.
أمثلة حاسمة على انخفاض درجة الحرارة المسموح به قبل التكثيف (للهواء الأولي عند 35 درجة مئوية):
- عند 20٪ رطوبة نسبية: يجب أن تنخفض درجة الحرارة 28 درجة مئوية (حتى 7 درجات مئوية) للتكثيف (خطر منخفض).
- عند 50٪ رطوبة نسبية: يكفي أن تنخفض 12 درجة مئوية (حتى 23 درجة مئوية).
- عند 75٪ رطوبة نسبية: مع انخفاض 5 درجات مئوية فقط (حتى 30 درجة مئوية) يحدث التكثيف (خطر مرتفع جدًا).
هذا أمر بالغ الأهمية في النقل البحري، حيث تعاني الحاويات من اختلافات حرارية كبيرة.
7.3. الحماية من الأشعة فوق البنفسجية تعمل الأشعة فوق البنفسجية (الشمسية أو من أنابيب الفلورسنت في مصائد الحشرات) على تدهور الورنيش والليثوغرافيا، مما يضعف الحاجز الواقي الخارجي.
8. طرق الحماية والاستنتاج
تعتمد مكافحة التآكل على الوقاية. تشمل الاستراتيجيات الأساسية:
- الحفاظ على سلامة الورنيش: يركز الورنيش المكسور الهجوم الأنودي.
- إزالة المخلفات المسترطبة: تنظيف شامل للعبوات بعد الإغلاق.
- التجفيف المطلق: تجنب الماء في الشقوق (الأغطية، الحلقات).
- التحكم البيئي: مستودعات جافة وجيدة التهوية مع التحكم في درجة الحرارة لتجنب نقطة الندى.
- استخدام المثبطات: المعالجة الكيميائية لمياه المعالجة (التخميل).
في الختام، التآكل في العبوات المعدنية هو ظاهرة متعددة العوامل تشمل الكيمياء وعلم المعادن والفيزياء الجوية، ويعتمد التحكم فيها على الإدارة المتكاملة لدورة حياة العبوة بأكملها.